- Blutzucker
-
 Im Bild die Schwankungen des Blutzuckers (rot) und des Blutzucker kontrollierenden Hormons Insulin (blau) beim gesunden Menschen über den Tagesverlauf mit drei Mahlzeiten. Ebenfalls aufgezeigt ist der Einfluss einer zuckerhaltigen (gestrichelt) gegenüber einer stärkehaltigen (durchgezogene Linie) Mahlzeit.[1]
Im Bild die Schwankungen des Blutzuckers (rot) und des Blutzucker kontrollierenden Hormons Insulin (blau) beim gesunden Menschen über den Tagesverlauf mit drei Mahlzeiten. Ebenfalls aufgezeigt ist der Einfluss einer zuckerhaltigen (gestrichelt) gegenüber einer stärkehaltigen (durchgezogene Linie) Mahlzeit.[1]
Unter Blutzucker versteht man im Allgemeinen die Höhe des Glucoseanteils (Glucosespiegel) im Blut. Glucose ist ein wichtiger Energielieferant des Körpers. Das Gehirn, die roten Blutkörperchen und das Nierenmark sind zur Energiegewinnung auf Glucose angewiesen, alle anderen Körperzellen gewinnen sie vorrangig im Fettstoffwechsel. Glucose ist in der Lage, die Blut-Hirn-Schranke zu überwinden und versorgt so das Gehirn.
In der Medizin ist der Blutzuckerwert ein wichtiger Messwert. Ist er dauerhaft erhöht, liegt in der Regel ein Diabetes mellitus vor. Mögliche Symptome sind ständiges Durstgefühl, häufiges Wasserlassen, eine neu aufgetretene Infektneigung bis hin zu massivem Gewichtsverlust innerhalb von Wochen bis wenigen Monaten mit anderen schweren Krankheitssymptomen.
Eine Unterzuckerung kann die Hirnleistung vermindern, Krampfanfälle, eine vermehrte Adrenalinausschüttung und zittrige Hände sowie Schweißausbrüche verursachen. In ausgeprägter Form führt die Unterzuckerung zum Schock. Sie findet sich typischerweise beim sehr seltenen Insulinom, in einigen Fällen aber auch als Frühsymptom eines Typ-2-Diabetes, selten auch ohne weitere Erkrankungen nach einer Mahlzeit mit schnell resorbierbaren Kohlenhydraten. In der Behandlung des Diabetes mellitus ist sie eine häufige Komplikation einiger Medikamente.
Inhaltsverzeichnis
Blutzuckermessung
Der Blutzucker wird aus einer Blutprobe in der Regel aus Kapillarblut gemessen. Aus Sicht der Messgenauigkeit zu unterscheiden sind die Messungen durch den Patienten selbst mithilfe von Blutzuckermessgeräten und qualitativ höherwertige Messungen im Labor.
Als Maßeinheit wird in den meisten Ländern die SI-konforme (Internationales Einheitensystem) Einheit mmol/l (Millimol pro Liter) verwendet. In Deutschland wird wie beispielsweise auch in den USA, Polen, Frankreich und Japan in der Regel noch mit der älteren Einheit mg/dl (Milligramm pro Deziliter) gemessen. Eine Zeit lang waren Messgeräte im Umlauf, die das Ergebnis wahlweise in mg/dl oder in mmol/l anzeigen konnten; laut Bundesinstituts für Arzneimittel und Medizinprodukte führte dies allerdings in mehreren Fällen zu Verwechslungen der zugrunde liegenden Maßeinheit, die eine falsche Dosierung des Insulins zur Folge hatten. Daher sind seit dem vierten Quartal 2006 kaum noch umstellbare Geräte im Handel. Eine ähnliche Problematik gab es auch in der Schweiz. Da der Umrechnungsfaktor jedoch größer als die üblichen Schwankungen des Blutzuckerspiegels ist, ist normalerweise schon anhand der Größenordnung des abgelesenen Wertes klar zu erkennen, in welcher Maßeinheit der Wert angezeigt wird (Werte kleiner als 25 sind wahrscheinlich mmol/l Angaben, größer als 25 wahrscheinlich mg/dl).
Umrechnung:
 oder
oder 
Der Blutzuckerspiegel kann heute mit kleinen Blutzuckermessgeräten, die wahlweise mit herstellerseitig programmierten Maßeinheiten entweder in mmol/l oder mg/dl erworben werden können, sehr schnell und weitgehend zuverlässig bestimmt werden.
Normalwerte
Beim Menschen betragen die Normalwerte:
- nüchtern: 70–99 mg/dl, entsprechend 3,9–5,5 mmol/l[2]
- nach einer kohlenhydratreichen Mahlzeit:
- maximal bis zu 160 mg/dl, entsprechend 8,9 mmol/l
- unter 140 mg/dl nach 2 Stunden, entsprechend 7,8 mmol/l[2]
Allerdings differieren die Werte je nach Literaturquelle (s.u.) und Kontrollmedium (venöses Plasma, venöses Vollblut oder kapilläres Vollblut - siehe Tabellen). Werte für Nüchternblutzucker (NBZ) > 5,5 mmol/l bzw. > 99 mg/dl (nach anderen Quellen > 6,1 mmol/l bzw. 110 mg/dl) lassen auf eine gestörte Glucosetoleranz oder gar auf einen Diabetes mellitus schließen. Als Komplikation führen deutlich erhöhte Werte z.B. im Rahmen einer Wundbehandlung zu einer verlängerten / gestörten Wundheilung. Gegebenenfalls muss dann bei Diagnose eines Diabetes mellitus u.a. zur Unterstützung der Wundheilung mit Insulin behandelt werden.
2006er WHO Diabetes/Blutzucker Kriterien und Einstufung[3] Einstufung Nüchternblutzucker
(NBZ, venös)Blutzucker 2 Stunden nach
dem Essen (oder oGTT) (venös)Normal < 110 mg/dl
< 6,1 mmol/l< 140 mg/dl
< 7,8 mmol/lAbnorme
Nüchternglukose (IFG)≥ 110–< 126 mg/dl
≥ 6,1–< 7,0 mmol/l< 140 mg/dl
< 7,8 mmol/lGestörte
Glukosetoleranz (IGT)< 126 mg/dl
< 7,0 mmol/l≥ 140–< 200 mg/dl
≥ 7,8–< 11,1 mmol/lDiabetes mellitus ≥ 126 mg/dl
≥ 7,0 mmol/l≥ 200 mg/dl
≥ 11,1 mmol/lAbkürzungen in obiger Tabelle:
2010er Kriterien für Kinder und Jugendliche der DDG[5] Blutzuckerkontrolle Stoffwechsel
gesundBlutzucker nüchtern > 65–< 100 mg/dl
> 3,6–< 5,6 mmol/lBlutzucker
nach dem Essen> 80–< 126 mg/dl
> 4,5–< 7,0 mmol/lBlutzucker nachts > 65–< 100 mg/dl
> 3,6–< 5,6 mmol/lHbA1c Wert
(standardisierter Wert
nach DCC-Trials)< 6,05 Blutzucker-Werte gemäß den Leitlinien der DDG vom 3. Mai 2008[6] [7] Messung Normale Werte Verdacht Diabetes
mellitusnüchtern < 100 mg/dl
< 5,5 mmol/l100–110 mg/dl
5,5–6,1 mmol/l> 110 mg/dl
> 6,1 mmol/l2 Std.
nach dem Essen
oder im oGTTkapillär < 140 mg/dl
< 7,8 mmol/l140–200 mg/dl
7,8–11,1 mmol/l> 200 mg/dl
> 11,1 mmol/lvenös < 120 mg/dl
< 7,0 mmol/l120–180 mg/dl
7,0–10,0 mmol/l> 180 mg/dl
> 10,0 mmol/lHbA1c < 6,5 % 6,5–7,5 % > 7,5 % Einen zu hohen Blutzuckerwert nennt man Hyperglykämie, einen zu niedrigen Hypoglykämie.
Eine Sonderform des Hämoglobin, das HbA1c, ist in der Lage, den Blutzuckerverlauf über maximal drei Monate wiederzugeben und wird deswegen auch das „Blutzuckergedächtnis“ genannt. Hämoglobin ist der rote Blutfarbstoff in den Erythrozyten, der Sauerstoff transportiert. HbA1c ist Hämoglobin, das aufgrund einer zu hohen Blutzuckerkonzentration nicht-enzymatisch glykiert wurde. Das HbA1c gibt Auskunft über die letzten drei Monate, da die Lebensdauer der Erythrocyten 120 Tage beträgt.
Messmethoden
Bei den Blutzuckermessgeräten zur Selbstkontrolle haben sich im Wesentlichen drei Messmethoden etabliert:
Optische Messung
Bei der optischen Messung wird das Blut im Teststreifen über eine Kapillare zu einem von außen sichtbaren Testfeld eingezogen. Dort sind verschiedene chemische Stoffe eingelagert, die mit dem Blut reagieren, was zu einer Farbänderung des Testfeldes führt. Diese Farbänderung wird vom Messgerät erfasst und aus der Dauer und Stärke der Änderung der Blutzuckerwert bestimmt.
Amperometrische Messung
Bei der amperometrischen Messung wird das Blut im Teststreifen über eine Kapillare in ein Testfeld gesaugt. Im Testfeld hat das Blut Kontakt zu Glucose-Oxidase und zu verschiedenen Elektroden. Das Messgerät legt an diese Elektroden eine definierte elektrische Spannung (ca. 300–600 mV) an und misst im Zeitverlauf den fließenden Strom, der über die Elektroden fließt. Aus dem gemessenen Strom bestimmt das Gerät dann den Blutzuckerwert. Der Strom ist proportional zur Glukosekonzentration der Flüssigkeit im Containment (Sensorbereich der Kapillare).
Nicht-invasive Messung
Bei verletzungsfreien, so genannten nicht-invasiven Methoden, kann der Blutzuckerwert angezeigt, verfolgt oder im Zeitverlauf aufgezeichnet werden, ohne Blut entnehmen zu müssen:
- Eine optische Spektralanalyse des sehr gut durchbluteten Augenhintergrundes kann sehr genaue Werte liefern[8]. Dazu kann auch ein implantierter passiver Mikrosensor im Auge die Qualität der Messungen erhöhen.
- Mit einem dauerhaft implantierten Mikrospektrometer ohne bewegliche Komponenten kann die spektroskopische Messung des Blutzuckers im nahen Infrarot-Bereich (NIR) erfolgen (IR-Spektroskopie). Dieser Sensor überträgt seine Messwerte mit einem passiven Transponder an ein Anzeigegerät[9].
- Mit einem breitbandigen Laser im mittleren Infrarot-Bereich (MIR) kann durch die Haut hindurch verletzungsfrei der Blutzuckerwert gemessen werden[10].
Diese und weitere nicht-invasive Methoden befinden sich noch in der Erforschung oder in der klinischen Zulassung (insbesondere in den USA); neu entwickelt wurde an der amerikanischen Northeastern University in Boston ein glukose-empfindlicher Nanosensor, dessen Nanopartikel nach Art eines Tattoos injiziert werden und bei erhöhten Blutzuckerwerten fluoreszieren[11].
Grundsätzlich ist mit diesen und ähnlichen Messverfahren eine permanente Aufzeichnung beziehungsweise Darstellung des Zeitverlaufes (Monitoring) des Blutzuckerspiegels möglich.
Eine Markteinführung der noninvasiven Blutglucose-Messung durch spektroskopische Messverfahren im Bereich des Nahinfrarot (NIR) mit extracorporal messenden Geräten scheiterte bisher daran, dass die Geräte den Gewebezucker, d. h. Glucose pro Volumen des durchstrahlten Körpergewebes und nicht den Blutzucker pro Blutvolumen bestimmen, weil der Messstrahl für die Messung das Körpergewebe durchdringen muss.
Glucosebestimmung im Urin
Des Weiteren ist eine Messung des Harnglucosewertes möglich. Glucose lässt sich aber nur dann im Urin nachweisen, wenn die Glucosekonzentration stark erhöht ist und einen bestimmten Wert überschritten hat. Dieser Wert ist abhängig von der so genannten Nierenschwelle des jeweiligen Probanden. Diese Nierenschwelle ist jedoch sehr unzuverlässig und leicht störbar. So kann z.B. bei Schwangerschaft die Nierenschwelle auf unter 120 mg/dl absinken, bei Gesunden kann sie auch über 200 mg/dl liegen. Selbst leichte Nierenerkrankungen können die Nierenschwelle verändern. Aufgrund der relativ hohen Zuverlässigkeit und guten Verfügbarkeit der Blutzuckermessgeräte bei gleich hohen Preisen für die Messstreifen kann die Bestimmung des Harnzuckers als überholt angesehen werden.
Regulation
Der Blutzuckerspiegel wird durch das Wechselspiel zweier Peptidhormone der Bauchspeicheldrüse (Pankreas) reguliert. Diese Drüse enthält in ihren α- und β-Zellen Blutzucker-Sensorsysteme, die wie folgt ansprechen:
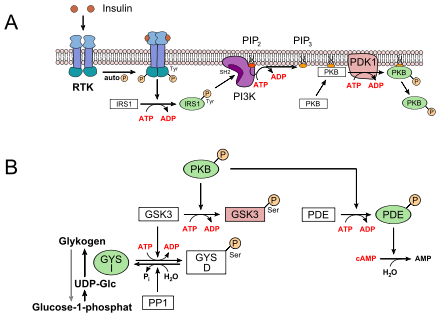
- bei Abfall des Zuckerspiegels im Blut („Hungersignal“) wird Glucagon sezerniert. Dieses Hormon aktiviert in der Leber die Glycogenphosphorylase (PYG), welche den Abbau von Glykogen zu Glucose einleitet (kataboler Ast) (oberes Bild)
- bei Anstieg des Blutzuckerspiegels wird Insulin sezerniert, das besonders in der Leber eine Serie Glucose-verbrauchender Reaktionen initiiert (anaboler Ast). Von zentraler Bedeutung ist hier die indirekte Aktivierung der Glykogensynthase (GYS), die den Glucose-Überschuss zum Aufbau des Energiespeichers Glykogen („tierische Stärke“) nutzt (unteres Bild)
Außerdem wird durch Adrenalin die gleiche Reaktion in Muskelzellen ausgelöst wie Glucagon auf Leberzellen wirkt.
Glykogenab- und -aufbau sind über die Phosphorylierung der Schlüsselenzyme Glykogenphosphorylase (PYG) und Glykogensynthase (GYS) strikt gegenläufig reguliert, verlaufen also nie gleichzeitig. In Energiemangelsituationen werden beide Enzyme durch Kinasen phosphoryliert; dieser Vorgang stimuliert die Phosphorylase, hemmt aber die Synthase. Bei Glucoseüberschuss wird die Situation durch Wirkung von Phosphatasen in das Gegenteil verkehrt: Verlust der Phosphatreste inaktiviert PYG, aktiviert aber GYS.
Sowohl das Glucagon- als auch das Insulinsignal werden über Signalkaskaden verstärkt. Im Zentrum beider Signalwege stehen Proteinkinasen: Jede Kinase phosphoryliert mehrere Moleküle einer nachgeschalteten Kinase.
- Im Fall des Glucagons bzw. Adrenalins wird ein G-Protein-abhängiger Rezeptor (GPCR, Sieben-Transmembran-Helix-Typ) angesteuert. Über das Gs-Protein wird Adenylatcyclase aktiviert, ein Enzym, das den second messenger cAMP produziert. Hierdurch wird die Proteinkinase A (PKA)-Kaskade initiiert, an deren Ende die Glykogenphosphorylase (PYG) steht. Nach Phoshorylierung wird sie aktiviert (PYG a). Diese setzt Glucose-1-phosphat aus Glykogen frei, was zu Glucose-6-phosophat isomerisiert wird und in die Glykolyse eintreten kann. Gleichzeitig phosphoryliert PKA auch die Glykogensynthase (GYS a), die in ihrer phosphorylierten Form (GYS b) inaktiv ist.
- Im Fall des Insulins wird eine Rezeptor-Tyrosinkinase (RTK) aktiviert. Auf dem Wege einer komplexen Signaltransduktion wird hier u. a. die Proteinkinase B (PKB) aktiviert (siehe unteres Bild, A). PKB phosphoryliert die Glykogensynthase-Kinase 3, GSK3, die dadurch inaktiviert wird. GSK3 ist eine Kinase, die die Glykogensynthase phosphoryliert und damit inaktiviert (GYS b). GSK3 steht in Konkurrenz zu einer Phosphatase, der Protein-Phosphatase 1 (PP1). Dadurch, dass GSK3 nicht mehr wirken kann, liegt daher immer mehr Glykogensynthase in seiner dephosphorylierten Form vor (GYS a, siehe unteres Bild, B). Außerdem aktiviert die PKB eine Phosphodiesterase, PDE, die cAMP zu AMP hydrolysiert. Infolgedessen erlischt zusätzlich der Signalweg für die PKA.
Siehe auch
Einzelnachweise
- ↑ Mark E Daly: Acute effects on insulin sensitivity and diurnal metabolic profiles of a high-sucrose compared with a high starch diet. (PDF) In: American Society for Clinical Nutrition (Hrsg.): Am J Clin Nutr 1998. Nr. 67, 1998, S. 1186-1196. Abgerufen am 19. Februar 2011.
- ↑ a b Leitlinie für die postprandiale Diabeteseinstellung (pdf) S. 22. International Diabetes Federation (2008). Abgerufen am 30. Juli 2011.
- ↑ Definition and Diagnosis of Diabetes Mellitus and Intermediate Hyperglycemia (englisch) (pdf). World Health Organization S. 36. www.who.int (2006). Abgerufen am 20. Februar 2011.
- ↑ a b M. A. Rahim, A. K. Azad Khan, Q. Nahar, S. M. Ali, A. Hussain: Impaired fasting glucose and impaired glucose tolerance in rural population of Bangladesh. In: Bangladesh Medical Research Council bulletin Band 36, Nummer 2, August 2010, S. 47–51, ISSN 0377-9238. PMID 21473200.
- ↑ Holterhus, Paul-Martin u.a.: Diagnostik, Therapie, Verlaufskontrolle des Diabetes Mellitus im Kindes und Jugendalter (pdf), S. 18, www.deutsche-diabetes-gesellschaft.de 2010 (Zugriff am 20. Februar 2011)
- ↑ Gemeinsam gegen Diabetes: Blutzucker
- ↑ Kellerer, M. et.al. (1. Oktober 2010): Diabetologie und Stoffwechsel S. 109-112. DDG. Abgerufen am 3. März 2011.
- ↑ Nicht-invasive Blutzuckermessung, Universität Karlsruhe, Institut für Technik und Informationsverarbeitung, 2004.
- ↑ In vivo Messung und Regelung des Blutzuckerspiegels, RWTH Aachen, Lehrstuhl für medizinische Informationstechnik
- ↑ Towards Broad Gain Mid-IR Lasers, Fraunhofer Institut, IAF, 2003.
- ↑ Clark Lab. In: nuweb9.neu.edu. Archiviert vom Original am 27. Juli 2011, abgerufen am 27. Juli 2011.

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.