- Nikotinerg
-
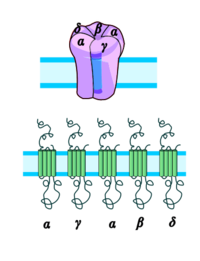
Nikotinischer Acetylcholinrezeptor Der ACh-n-Rezeptor aus dem Zitterrochen (Torpedo). Oben: Seitenansicht in der Zellmembran. Unten: Draufsicht. Das Substrat ACh (rot) bindet an die α-Untereinheiten (orange), nach PDB 2BG9 Größe 2370 = 2*462 + 478 + 495 + 473 Aminosäuren (2α1β1γε) Struktur Pentamer ααβγδ oder ααβγε Transporter-Klassifikation TCDB 1.A.9.1.1 Bezeichnung Ligandengesteuerte Ionenkanäle Vorkommen Übergeordnetes Taxon Mehrzellige Tiere Nikotinische Acetylcholinrezeptoren oder Nikotinrezeptoren sind membranständige Rezeptoren in verschiedenen Bereichen des Nervensystems und der motorischen Endplatte, die als Substrat den Neurotransmitter Acetylcholin (ACh) binden, aber auch durch Nikotin aktiviert werden können. Substanzen, die an diese Rezeptoren binden, werden als nikotinerg klassifiziert.
Gut untersucht sind diese Rezeptoren an der Verbindungsstelle von Nerv und Muskel, der neuromuskulären Endplatte. Für eine Kanalöffnung müssen jeweils zwei ACh-Moleküle an den Rezeptor binden. Dies macht den Kanalöffnungsmechanismus unempfindlich gegen kleine Neurotransmitterkonzentrationen und hoch empfindlich für Konzentrationen, wie sie während der synaptischen Übertragung vorliegen. Beim Krankheitsbild der Myasthenia gravis werden diese ACh-Rezeptoren durch Autoimmunprozesse zerstört und damit die Übertragung der neuronalen Signale auf den Muskel gestört.
Inhaltsverzeichnis
Aufbau
Dieser Rezeptor wird als Prototyp seiner Klasse angesehen. Er ist verwandt mit dem ionotropen Serotonin-(5-HT3)-Rezeptor, dem GABAA-Rezeptor und dem Glycin-Rezeptor. Der nicotinerge ACh-Rezeptor ist ein zylindrisches Transmembranprotein bestehend aus 5 Untereinheiten (2x α1-, β1-, γ-, δ-Untereinheit), von denen jede jeweils viermal die Zellmembran durchspannt. DNA-Sequenzierungen haben ergeben, dass die beiden α-Untereinheiten wiederum aus acht Untertypen bestehen: α1–α8. Durch das Auftreten verschiedener Untereinheiten, die jeweils einen Rezeptor-Komplex bilden können, entsteht eine Vielzahl von verschiedenen Rezeptor-Isoformen, die sich durch eine unterschiedliche Zusammensetzung der Untereinheiten auszeichnen, unterschiedliche pharmakokinetische Eigenschaften besitzen und spezifisch zwischen Organen und innerhalb des ZNS verteilt sind [Vgl. Shepard, 2004: The synaptic organization of the brain]. So kann man grob zwischen einem Muskeltyp und einem Neuronentyp unterscheiden, je nachdem, ob sich der Rezeptor in der Muskulatur oder dem Nervensystem befindet.
Kinetik
Die α-Untereinheiten des Rezeptors besitzen jeweils eine Bindungsstelle für Acetylcholin (zwei Bindungsstellen pro Rezeptor). Wenn diese Bindungsstellen durch den Transmitter besetzt sind, ändert sich durch die Interaktion mit dem gebundenen Molekül die dreidimensionale Struktur und es eröffnet sich eine Kanalpore, durch die Ionen durch die Zellmembran gelangen können. Dieser Mechanismus wurde erst vor kürzerer Zeit aufgedeckt. Natrium und Calcium-Ionen strömen somit in die Zelle ein, Kalium strömt (in wesentlich geringerer Menge) aus der Zelle hinaus. Durch die Ladungsverschiebungen entsteht ein Strom über die Zellmembran, den man entsprechend seiner Richtung (von außen in die Zelle hinein) als Depolarisation der Zelle bezeichnet, da er die vorbestehende polare Ladungsverteilung an der Zellmembran (innen negativ, außen positiv) vermindert und kurzzeitig sogar umkehren kann.
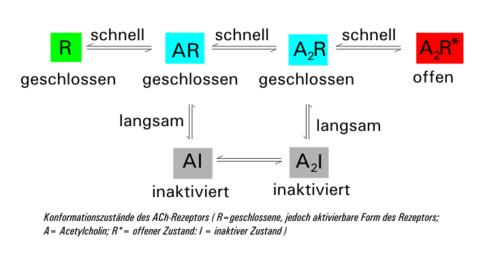
Der ligandenbesetzte Rezeptor kommt in zwei Formen vor: einmal als geschlossener (A2R) und einmal als offener (A2R*). Diese beiden Zustände können schnell ineinander übergehen. Parallel dazu geht die geschlossene Form (A2R) mit zeitlicher Verzögerung in die inaktive Form (A2I) über (Desensitisierung), die sich unter weiterer Abspaltung von ACh über AI wieder in die geschlossene Form AR umwandelt. Sinkt die Acetylcholin-Konzentration durch die Aktivität der Acetylcholinesterase wieder unter 10 nM, so regeneriert der Rezeptor wieder zur ursprünglichen Form R. Die Zeitkonstante der Desensitisierung (mittlere Zeit zum Schließen des Kanals) beträgt bei einer ACh-Konzentration von 1 mM rund 20–50 ms.
Aufgrund der Brownschen Molekularbewegung diffundieren die ACh-Moleküle nach kurzer Zeit wieder von der Bindungsstelle ab und werden durch das Enzym Acetylcholinesterase zu Cholin und einem Acetylrest abgebaut. Dadurch schließt sich der Rezeptor wieder.
Pharmakologische Beeinflussung
Zahlreiche Medikamente sowie pflanzliche Alkaloide beeinflussen diesen Rezeptor. An der motorischen Endplatte blockiert das Pfeilgift Curare (aus Chondodendron tomentosum) kompetitiv und das Schlangengift α-Bungarotoxin irreversibel die Anlagerung von ACh an den Rezeptor. Medizinisch nutzt man Curare neben Atracurium als sog. nicht-depolarisierende Muskelrelaxantien. Suxamethonium (Succinylcholin) ist eine Substanz, die den ACh-Rezeptor dauerhaft öffnet, da es nicht durch die Acetylcholineseterase abgebaut wird. Dieser Arzneistoff wirkt ebenfalls als Muskelrelaxans, jedoch über einen Depolarisationsblock: Die „Abschaltung“ (Desensitisierung) des Rezeptors kann ohne zwischenzeitlichen, ligandenfreien Zustand nicht aufgehoben, der Rezeptor nicht aktivierbar gemacht werden.
Den ACh-Rezeptor vom Neuronentyp (s.o.) kann man spezifisch mittels Hexamethonium oder Pentamethonium blockieren. Früher wurden solche Arzneistoffe als Ganglienblocker benutzt, heute sind sie wegen der zahlreichen Nebenwirkungen (Ausschalten des gesamten vegetativen Nervensystems) jedoch obsolet. Nikotin (das Gift des Tabaks), Coniin (das Gift des Schierlings) und Cytisin (das Gift des Goldregens) öffnen diesen neuronalen ACh-Rezeptor und sind wegen ihrer starken Wirkung auf das vegetative Nervensystem höchst toxisch (Herzstillstand, Atemlähmung).
Medizinische Bedeutung
Beim Krankheitsbild der Myasthenia gravis produziert der Körper Autoantikörper gegen den nicotinergen ACh-Rezeptor vom muskulären Typ und führt daher zu einer Muskelschwäche. Es folgt eine Aufstellung der möglichen Rezeptor-Untereinheiten, der Position ihres Gens im Genom und möglicher Krankheitsbilder bei Mutation desselben.
UE Typ UniProt Genlocus OMIM Pathologie α1 Muskel P02708 2q24-q32 [1] Myasthenia gravis; multiples Pterygium-Syndrom, letaler Typ; myasthenisches Syndrom (SCCMS, FCCMS) α2 Neuron Q15822 8p21 [2] Nächtliche Frontallappen-Epilepsie (ENFL4) α3 Neuron P32297 15q24 [3] Anfälligkeit für Lungenkrebs (LNCR2); Anfälligkeit für periphere arterielle Verschlusskrankheit (PAOD2) α4 Neuron P43681 20 [4] Nächtliche Frontallappen-Epilepsie (ENFL1) α5 Neuron P30532 15q24 [5] Anfälligkeit für Lungenkrebs (LNCR2) α6 Neuron Q15825 8p22 [6] α7 Neuron P36544 15q13.3 [7] β1 Muskel P11230 17p12-p11 [8] Myasthenisches Syndrom (SCCMS, ACHRDCMS) β2 Neuron P17787 1q21.3 [9] Nächtliche Frontallappen-Epilepsie (ENFL3) β3 Neuron Q05901 8 [10] β4 Neuron P30926 15q24 [11] γ P07510 2q33-34 [12] Escobar-Syndrom; multiples Pterygium-Syndrom, letaler Typ δ Q07001 2q33-qter [13] Multiples Pterygium-Syndrom, letaler Typ; myasthenisches Syndrom (SCCMS, FCCMS) ε Q04844 17p13.2 [14] Myasthenia gravis; myasthenisches Syndrom (SCCMS, FCCMS, ACHRDCMS) Siehe auch
Weblinks
Wikimedia Foundation.