- Phenylalaninhydroxylase
-
Phenylalaninhydroxylase —
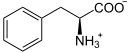
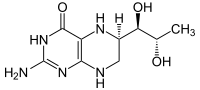
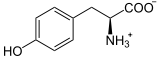
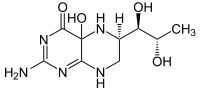
Masse/Länge Primärstruktur 452 Aminosäuren Sekundär- bis Quartärstruktur Homodimer Kofaktor Fe2+, Tetrahydrobiopterin Bezeichner Gen-Name PAH Externe IDs OMIM: 261600 UniProt: P00439 Enzymklassifikation EC, Kategorie 1.14.16.1 Monooxygenase Substrat L-Phenylalanin + Tetrahydrobiopterin + O2 Produkte L-Tyrosin + 4a-Hydroxytetrahydrobiopterin Vorkommen Homologie-Familie Phenylalaninhydroxylase Übergeordnetes Taxon Lebewesen Die Phenylalaninhydroxylase (PAH) ist dasjenige Enzym, das in allen Lebewesen den Umbau von L-Phenylalanin zu Tyrosin katalysiert. Es ist daher unentbehrlich für alle Eukaryoten, für die hohe Konzentrationen von Phenylalanin im Organismus schädlich sind. PAH ist eisenhaltig und bindet Tetrahydrobiopterin als Cofaktor. Beim Menschen kommt es hauptsächlich in der Zellflüssigkeit (dem Cytosol) von Leberzellen vor. Mutationen am PAH-Gen können zu geringerer bis fehlender Aktivität des Enzyms und entsprechend zu Hyperphenylalaninämie bis hin zur Phenylketonurie führen.[1]
Katalysiertes Reaktionsgleichgewicht
Phenylalanin wird zu Tyrosin oxidiert und umgekehrt.
Einzelnachweise
Weblinks
 Wikibooks: Biochemie und Pathobiochemie: Phenylalanin-Hydroxylase – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Phenylalanin-Hydroxylase – Lern- und Lehrmaterialien Wikibooks: Biochemie und Pathobiochemie: Biopterin-Stoffwechsel – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Biopterin-Stoffwechsel – Lern- und Lehrmaterialien- Jennifer McDowall/Interpro: Protein Of The Month: Phenylalanine hydroxylase. (engl.)
Kategorien:- Oxygenase
- Krankheitsassoziiertes Protein
Wikimedia Foundation.