- Phenylalaninquelle
-
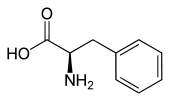
Strukturformel 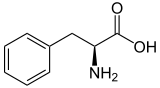
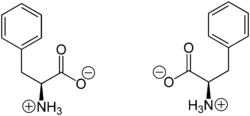
L-Phenylalanin (links) bzw. D-Phenylalanin (rechts)Allgemeines Name Phenylalanin Andere Namen - L-Phenylalanin
- (S)-Phenylalanin
- D-Phenylalanin
- (R)-Phenylalanin
- DL-Phenylalanin
- (RS)-Phenylalanin
- 2-Amino-3-phenyl- propionsäure
- Abkürzungen
- Phe (Dreibuchstabencode)
- F (Einbuchstabencode)
Summenformel C9H11NO2 CAS-Nummer - 63-91-2 (L-Enantiomer)
- 673-06-3 (D-Enantiomer)
PubChem 6140 DrugBank DB00120 Kurzbeschreibung weißes Pulver Eigenschaften Molare Masse 165,19 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit gut in Wasser lösbar: 27 g·l−1 (20 °C)[1])
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phenylalanin ist eine chirale, aromatische α-Aminosäure mit hydrophober Seitenkette, die in ihrer L-Form in der Natur als Proteinbestandteil vorkommt und für den Menschen eine essentielle proteinogene (am Eiweißaufbau beteiligte) Aminosäure ist. Phenylalanin leitet sich strukturell vom Alanin ab und ist amphiphil. Die D-Form ist für den Stoffwechsel nicht verwertbar und auch nur synthetisch herstellbar. In der Biochemie wird für L-Phenylalanin mit dem Dreibuchstabencode Phe oder dem Einbuchstabencode F abgekürzt.
Inhaltsverzeichnis
Historische Informationen
L-(−)-Phenylalanin [CIP-Nomenklatur: (S)-Phenylalanin] konnte zuerst im Jahr 1879 aus Leguminosen isoliert werden und wurde 1882 erstmals synthetisch dargestellt.
Biosynthese
L-(−)-Phenylalanin wird in Pflanzen über den Shikimisäureweg synthetisiert. Über den Zimtsäureweg lassen sich die Flavonoide aus L-(−)-Phenylalanin biosynthetisieren.
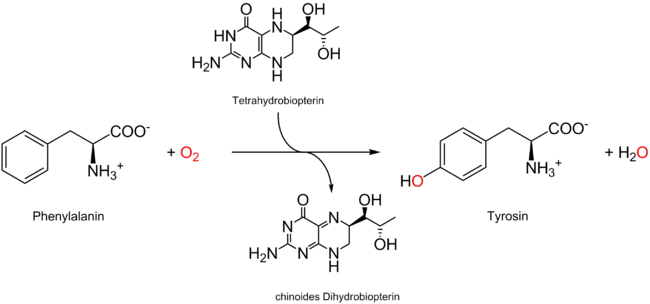
Durch 4-Hydroxylierung entsteht im menschlichen Körper aus L-(−)-Phenylalanin die proteinogene Aminosäure L-Tyrosin [Synonym: (S)-Tyrosin].
Vorkommen
L-(−)-Phenylalanin ist in vielen menschlichen Nahrungsmitteln enthalten, vor allem in Soja, aber auch Gemüse, Nüssen, Samen, Weizenkeimen, Milchprodukten, Fleisch und Fisch.
Das natürlich vorkommende L-Phenylalanin [Synonym: (S)-Phenylalanin] schmeckt in reiner Form bitter. Das unnatürliche D-Phenylalanin [Synonym: (R)-Phenylalanin] hinterlässt dagegen einen süßen Geschmackseindruck. Bei übermäßigem Verzehr kann Phenylalanin abführend wirken.
Eigenschaften
Phenylalanin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxylgruppe zum einsamen Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Phenylalanin auch seine geringste Löslichkeit in Wasser besitzt. Der isoelektrische Punkt von Phenylalanin liegt bei 5,48.[2]
Synthese
L-(−)-Phenylalanin wird, wie andere Aminosäuren auch, im industriellen Maßstab und in beträchtlichen Mengen hergestellt. Dies geschieht meist über Totalsynthese, das heißt ohne biotechnologische Hilfsmittel.
Auf biologischem Weg wird das L-Phenylalanin in Pflanzen über die Zwischenstufe der Shikimisäure gebildet.
Industrielle Verwendung
Der künstliche Süßstoff Aspartam ist ein L-Aspartyl-L-phenylalanylmethylester, also der Methylester eines Dipeptides aus L-Asparaginsäure und L-Phenylalanin. In der stereoselektiven Synthese sind (S)- oder (R)-Phenylalanin und deren Derivate als Edukte und enantioselektive Katalysatoren von Bedeutung.
Medizin
Für Menschen ist L-Phenylalanin eine essentielle Aminosäure, die im Stickstoffstoffwechsel eine wichtige Rolle spielt. In der Leber kann L-Phenylalanin – wenn ausreichend vorhanden – zu L-Tyrosin umgewandelt werden. Dies wird durch die Phenylalaninhydroxylase (EC 1.14.16.1), einer Monooxygenase, katalysiert. Das Reduktionsmittel hierbei ist Tetrahydrobiopterin.
Reicht die Menge L-Phenylalanin jedoch nicht aus, muss Tyrosin auch mit der Nahrung aufgenommen werden. Da bei starkem Stress dieser Mechanismus nicht mehr funktioniert, muss L-Tyrosin in solchen Fällen verstärkt aufgenommen werden. Die normale tägliche Dosis sollte 14 mg/kg Körpergewicht (eines Erwachsenen) betragen. Sie wird grundsätzlich ausreichend durch die Nahrung gedeckt (siehe auch oben).
L-Phenylalanin ist beteiligt an der Synthese von Adrenalin, Noradrenalin, L-Dopa, PEA und anderen Hormonen. Die Aminosäure L-Phenylalanin dient als Ausgangsstoff für viele weitere Stoffe, z. B. für die Botenstoffen Dopamin und Serotonin.
Racemische Gemische aus D- und L-Phenylalanin (DLPA) werden als Schmerzmittel oder auch bei Depressionen verabreicht. Sie wirken stimmungsaufhellend. Die vermutete schmerzstillende Wirkung von DL-Phenylalanin lässt sich durch die mögliche Blockade des Enkephalin-Abbaus von D-Phenylalanin durch das Enzym Carboxypeptidase A erklären [3]. Damit ist dies eines der seltenen Beispiele für metabolische Wirkungen von D-Enantiomeren. Eine genetisch bedingte Stoffwechselstörung ist Phenylketonurie (PKU), hier wird L-Phenylalanin im Körper nicht vollständig abgebaut. Die Erkrankten vertragen nur einen Bruchteil der üblichen Zufuhr phenylalaninhaltiger Stoffe und Nahrungsmittel. Das betrifft vor allem natürliches Eiweiß, aber auch synthetisch hergestellte Substanzen, wie z. B. der Süßstoff Aspartam. An PKU erkrankten Menschen fehlt das Enzym Phenylalaninhydroxylase. Es wandelt beim gesunden Menschen L-Phenylalanin in L-Tyrosin um. Fehlt das Enzym, steigt die Konzentration an L-Phenylalanin im Blut auf ein zu hohes Niveau an. Dies wirkt sich auf Reifung und Funktion des Gehirns ungünstig aus.
Siehe auch
- Homophenylalanin als Strukturmotiv in Arzneistoffen, vor allem ACE-Inhibitoren der 2. Generation.
Einzelnachweise
- ↑ a b c Sicherheitsdatenblatt (Merck)
- ↑ Hans-Dieter Jakubke und Hans Jeschkeit. Aminosäuren, Peptide, Proteine, Verlag Chemie, 1982, S. 40, ISBN 3-527-25892-2.
- ↑ Christianson DW, Mangani S, Shoham G, Lipscomb WN. "Binding of D-phenylalanine and D-tyrosine to carboxypeptidase A." Journal of Biological Chemistry 1989 Aug 5;264(22):12849-53. PMID: 2568989.
Literatur
- K. Drauz, A. Kleemann, J. Martens: Induktion von Asymmetrie durch Aminosäuren, in: Angew. Chem. 1982, 94, 590–613.
- J. Martens: Asymmetric Syntheses with Amino Acids, Topics in Current Chemistry, in: Fortschritte der Chemischen Forschung 1984, 125, 165–246.
- A. Kleemann, J. Martens, M. Samson, W. Bergstein: Asymmetric Synthesis of Peptides, in: Synthesis 1981, 740–741.
Weblinks
Bitte beachte den Hinweis zu Gesundheitsthemen! Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.