- 5,6-Dihydroxyindol-2-carbonsäure-Oxidase
-
5,6-Dihydroxyindol-2-carbonsäure-Oxidase —
Masse/Länge Primärstruktur 513 Aminosäuren Sekundär- bis Quartärstruktur single pass Typ 1 Membranprotein Kofaktor 2 Kupfer Bezeichner Gen-Name TYRP1 Externe IDs OMIM: 115501 UniProt: P17643 Enzymklassifikation EC, Kategorie 1.14.18.- Oxidoreduktase Substrat 5,6-Dihydroxyindol- 2-carboxylat (DHICA) Produkte (Poly-)Melanin Vorkommen Homologie-Familie Tyrosinase Übergeordnetes Taxon Lebewesen 5,6-Dihydroxyindol-2-carbonsäure-Oxidase, kurz DHICA-Oxidase (Gen: TYRP1, von früher Tyrosinase related protein 1 (Trp-1)) ist dasjenige Enzym, das 5,6-Dihydroxyindol-2-carbonsäure in Melanin umwandelt. Damit ist es unentbehrlich für einen von zwei Stoffwechselwegen, über die das Pigment Melanin in Melanocyten aufgebaut wird. Mutationen am TYRP1-Gen sind verantwortlich für Okulokutanen Albinismus Typ 3. Tiere, die mit diesem Enzym immunisiert werden, zeigen die Symptome des Vogt-Koyanagi-Harada-Syndroms.[1][2]
Inhaltsverzeichnis
Katalysierte Reaktion
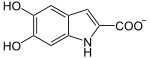 + 2 Ox. Akz. ⇒
+ 2 Ox. Akz. ⇒
⇒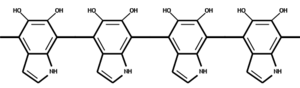 + 2 Red. Akz. + CO2
+ 2 Red. Akz. + CO2Von DHICA wird oxidativ der Carbonsäurerest abgespalten, und das Produkt polymerisiert zu Eumelanin, einem braun-schwarzes Pigment, das zusammen mit weiteren Pigmenten Haut und Haaren die Farbe verleiht.[3][4]
Weitere Funktionen
DHICA-Oxidase bildet Heterodimere mit Tyrosinase, stabilisiert diese und trägt so möglicherweise zur Regulation der Melaninsynthese durch Bildung eines Proteinkomplexes bei, dessen Transkription von einem Protein namens Mitf aktiviert wird.[5][6][7]
Hemmung
Der Wirkstoff Rucinol soll die Pigmentbildung gezielt durch Hemmung der Tyrosinase und des TRP-1 hemmen.[8]
Siehe auch
Einzelnachweise
- ↑ UniProt P17643
- ↑ Yamaki K, Ohono S: Animal models of Vogt-Koyanagi-Harada disease (sympathetic ophthalmia). In: Ophthalmic Res.. 40, Nr. 3-4, 2008, S. 129–35. doi:10.1159/000119863. PMID 18421226.
- ↑ Alonso S, Izagirre N, Smith-Zubiaga I, et al: Complex signatures of selection for the melanogenic loci TYR, TYRP1 and DCT in humans. In: BMC Evol. Biol.. 8, 2008, S. 74. doi:10.1186/1471-2148-8-74. PMID 18312627.
- ↑ Schmutz SM, Berryere TG: Genes affecting coat colour and pattern in domestic dogs: a review. In: Anim. Genet.. 38, Nr. 6, Dezember 2007, S. 539–49. doi:10.1111/j.1365-2052.2007.01664.x. PMID 18052939.
- ↑ Kobayashi T, Hearing VJ: Direct interaction of tyrosinase with Tyrp1 to form heterodimeric complexes in vivo. In: J. Cell. Sci.. 120, Nr. Pt 24, Dezember 2007, S. 4261–8. doi:10.1242/jcs.017913. PMID 18042623.
- ↑ Ray K, Chaki M, Sengupta M: Tyrosinase and ocular diseases: some novel thoughts on the molecular basis of oculocutaneous albinism type 1. In: Prog Retin Eye Res. 26, Nr. 4, Juli 2007, S. 323–58. doi:10.1016/j.preteyeres.2007.01.001. PMID 17355913.
- ↑ Denat L, Larue L: [Malignant melanoma and the role of the paradoxal protein Microphthalmia transcription factor.] In: Bull Cancer. 94, Nr. 1, Januar 2007, S. 81–92. PMID 17237008.
- ↑ Kim DS, Kim SY, Park SH, et al: Inhibitory effects of 4-n-butylresorcinol on tyrosinase activity and melanin synthesis. (PDF) In: Biol. Pharm. Bull.. 28, Nr. 12, Dezember 2005, S. 2216–9. PMID 16327152.
Weblinks
Wikimedia Foundation.
