- Reduktionspotential
-
Das Redoxpotential eines Systems ist ein Maß für die Bereitschaft, in einer chemischen Reaktionen Elektronen aufzunehmen und damit als Oxidationsmittel zu wirken.
- → Hauptartikel: Redoxreaktion
Ein "System" in diesem Sinne ist zum Beispiel gasförmiges Fluor:
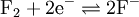 mit E°=2,87V. Fluor kann zwei Elektronen aufnehmen und so reduziert werden. Dabei entstehen aus einem Teil Fluor zwei Teile Fluorid.
mit E°=2,87V. Fluor kann zwei Elektronen aufnehmen und so reduziert werden. Dabei entstehen aus einem Teil Fluor zwei Teile Fluorid.Oxidationsmittel haben konventionsgemäß positive Redoxpotentiale, während Reduktionsmitteln negative Redoxpotentiale zugesprochen werden.
Da Potentiale nur relativ zu einem Bezugspunkt angegeben werden können, wurde die Standard-Wasserstoffelektrode als sogenanntes Bezugselement eingeführt.
- → Hauptartikel: Elektrochemisches Potential
In der Elektrochemischen Spannungsreihe sind die Redoxpotentiale relativ zur Normal-Wasserstoffelektrode angegeben. Diesem System wurde das Redoxpotential E°=0 V zugeordnet. Bei elektrochemischen Prozessen spricht man im Zusammenhang mit Systemen, die über ein Redoxpotential verfügen auch von Redoxpaaren oder Halbelementen.
Siehe auch: Galvanisches Element, Elektromotorische Kraft
Inhaltsverzeichnis
Festlegung eines Standardzustands: Standardpotentiale
Da Redoxpotentiale mehr oder minder stark von äußeren Bedingungen wie Druck, Temperatur oder dem pH-Wert abhängig sind, wurde zur besseren Vergleichbarkeit ein Zustand eingeführt, in dem sich die in der Elektrochemischen Spannungsreihe stehenden Halbelemente befinden. In diesem Zustand herrschen die Standardbedingungen: der Druck beträgt 1 atm, die Temperatur 298,15 [K], die Aktivität beträgt eins.
Beispiel: Kaliumpermanganat ist ein starkes Oxidationsmittel, die Oxidationskraft und damit das Redoxpotential hängen aber stark vom pH-Wert ab. Wird Kaliumpermanganat mit einem Reduktionsmittel versetzt, so können entsteht z.B. bei pH=1 Mangan-(II)-[Kation]en, bei pH=7 Braunstein und bei pH=14 Manganat-(VI)-Ionen.
Die Umrechnung vom Standardzustand zu jedem beliebigen anderen Zustand gelingt über die Nernst-Gleichung.
Messung und Quantifizierung
Neben der oben erwähnten Berechnung über die Nernst´sche Gleichung stehen noch verschiedene Messmethoden zur Bestimmung von Redoxpotentialen zur Verfügung:
Das Standard-Redoxpotential eines Systems lässt sich durch Aufbau eines Galvanischen Elements mit der Wasserstoffelektrode und Messung der elektrischen Spannung ermitteln. Dafür müssen aber beide Systeme im Standardzustand vorliegen.
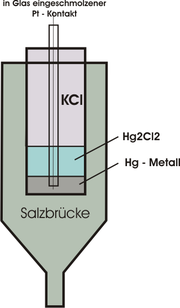
Redoxpotentiale sind auch durch Ermittlung der Spannung beim Zusammenschalten mit anderen Halbelementen, deren Redoxpotential bereits bekannt ist, zugänglich. Aus diesem Grund wird in der Praxis oft auf andere Halbelemente als Bezugselement zurück gegriffen. Gängig ist beispielsweise die [[1]], da mit ihr Potentialschwankungen durch Temperaturfluktuationen zu geringeren Messfehlern als bei der Wasserstoffelektrode führen.
Temperaturabhängigess Redoxpotential der Kalomelektrode rode[1] Temperatur Potentialdifferenz + 18 °C + 0,2511 V + 20 °C + 0,2496 V + 22 °C + 0,2481 V Wie aus der Tabelle ersichtlich wird, schwanken die Redoxpotentiale bei Erhöhung oder Erniedrigung um zwei Grad Celsius jeweils nur um rund 0,6%.
Redoxpotentiale in der Biochemie
Für biochemische Vorgänge rechnet man mit den auf pH 7 bezogenen Potentialen ΔEo'. Für Reaktionen, an denen Protonen beteiligt sind, ergibt sich somit eine Potentialdifferenz von 0,413 V, wie in der nachfolgenden Tabelle angegeben.
- Bitte beachten: werden Redoxpotentiale als Eo oder Eo' angegeben (Tabelle), so bezeichnen sie formal das Potential relativ zur Normal-Wasserstoffelektrode. Das Redoxpotential jeder anderen Reaktion, ΔEo bzw. ΔEo', ergibt sich dann durch Differenzbildung der zutreffenden Eo'-Werte.
Red/Ox n Eo [V] bei pH 0 Eo' [V] bei pH 7 Ferredoxin Fe2+/Fe3+ 1 −0,43 −0,43 ½ H2 /H+ 1 0 −0,413 NADH,H + / NAD+, 2H+ 2 +0,09 −0,32 Liponsäure: Lipons.-H2/Lipons., 2 H+ 2 +0,21 −0,20 Ethanol/Acetaldehyd 2 H+ 2 +0,21 −0,20 Flavin-Nucleotide (FAD, FMN): F-H2/ F, 2H+ 2 +0,22 −0,19*) Glutathion: 2GSH/(GS)2, 2 H+ 2 +0,31 −0,10 Suc/Fum, 2 H+ 2 +0,38 −0,03 Ascorbat/Dehydroasc., 2 H+ 2 +0,35 +0,06 Hydrochinon/Ubichinon, 2 H+ 2 +0,51 +0,10 H2O/½O2, 2 H+ 2 +1,23 +0,82 Häm-Eisen-Proteine Katalase Fe2+/Fe3+ 1 −0,5 −0,5 Peroxidase Fe2+/Fe3+ 1 −0,2 −0,2 Cytochrom b562 Fe2+/Fe3+ 1 −0,1 −0,1 Cytochrom b5 Fe2+/Fe3+ 1 +0 +0 Hämoglobin, Myoglobin Fe2+/Fe3+ 1 +0,1 +0,1**) Cytochrom c Fe2+/Fe3+ 1 +0,25 +0,25 - *) Bei Flavin-Nucleotiden handelt es sich um fest gebundene prosthetische Gruppen, deren genaues Redoxpotential vom Proteinpartner abhängt.
- **) Bemerkenswert ist die geringe Bereitschaft von Hämoglobin, Elektronen abzugeben: dies würde zum Funktionsverlust führen.
Siehe auch
Einzelnachweise
Wikimedia Foundation.