- Monophosphan
-
Strukturformel 
Allgemeines Name Monophosphan Andere Namen - Phosphin
- Phosphorwasserstoff
- Phosphan
Summenformel PH3 CAS-Nummer 7803-51-2 PubChem 24404 Kurzbeschreibung brennbares, giftiges, farb- und geruchloses Gas. Durch Verunreinigungen Geruch nach Knoblauch und faulem Fisch[1]
Eigenschaften Molare Masse 34,00 g·mol−1 Aggregatzustand gasförmig
Dichte 1,53 kg·m−3 (0 °C)[1]
Schmelzpunkt Siedepunkt −87,77 °C[1]
Dampfdruck Löslichkeit 330 mg·l−1 (20°C) in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 




Gefahr
H- und P-Sätze H: 220-330-314-400 EUH: keine EUH-Sätze P: 260-280-210-273-304+340-303+361+353-305+351+338-315-377-381-405-403 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Hoch-
entzündlichSehr giftig Umwelt-
gefährlich(F+) (T+) (N) R- und S-Sätze R: 12-17-26-34-50 S: (1/2)-28-36/37-45-61-63 MAK 0,14 mg·m−3[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Monophosphan, umgangssprachlich etwas unpräzise als Phosphorwasserstoff, Phosphan oder veraltet als Phosphin bezeichnet, gehört zur Gruppe der Phosphane. Monophosphan ist eine chemische Verbindung des Elements Phosphor mit der Summenformel PH3. Es ist ein brennbares, äußerst giftiges, im reinen Zustand geruchloses Gas. Reines Monophosphan ist erst bei 150 °C selbstentzündlich. Durch die Anwesenheit von Diphosphan P2H4 brennt kommerziell erhältliches und im Labor zubereitetes Gas jedoch auch bei Raumtemperatur beim Zutritt von Luft; das Diphosphan und andere Phosphane verleihen diesem gewöhnlichen, nicht ganz reinen Monophosphan einen starken Geruch nach Knoblauch.
Inhaltsverzeichnis
Gewinnung und Darstellung
Es gibt zahlreiche Möglichkeiten zur Darstellung von Monophosphan. Zum Beispiel disproportioniert weißer Phosphor (P4) im alkalischen Medium zu Phosphan und Phosphinsäure, welche bei höheren Temperaturen zu Monophosphan und Phosphonsäure disproportioniert, welche wiederum zu Phosphorsäure und Monophosphan disproportioniert:
Diese Methode wird technisch im Autoklaven bei 250 °C durchgeführt.
Analog zur Herstellung von Ammoniak (Haber-Bosch-Verfahren) kann auch eine Synthese aus den Elementen erfolgen:
Monophosphan entsteht auch bei der sauren Hydrolyse von salzartigen Phosphiden und Phosphonium-Salzen, sowie bei der Hydridolyse von Phosphorhalogeniden wie z. B. Phosphortrichlorid mit Lithiumaluminiumhydrid in Ether.
Eigenschaften
Physikalische Eigenschaften
Monophosphan ist in Wasser kaum löslich, die wässrige Lösung reagiert neutral.
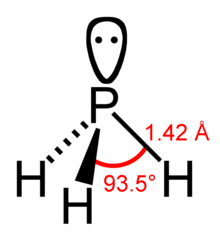
Das Molekül ist trigonal-pyramidal gebaut. Der Winkel zwischen den einzelnen Wasserstoffatomen beträgt 93,5°. Der Abstand zwischen dem Phosphor- und den Wasserstoffatomen beträgt 1,419 Å.
Kritische Temperatur 51,9 °C[1] Kritischer Druck 65,3 bar[1] Gibbs-Energie 13 kJ/mol Standardentropie 210 J/(mol·K) Wärmekapazität 37 J/(mol·K) Verdampfungsenthalpie 1 kJ/mol Elektrisches Dipolmoment 1,9·10−30 C·m Chemische Eigenschaften
Monophosphan ist eine schwache Base (pKb ~27). Mit Halogenwasserstoffsäuren reagiert es zu unbeständigen Salzen, den sogenannten Phosphoniumsalzen. Bei erhöhter Temperatur zersetzt es sich in die Elemente Wasserstoff und Phosphor.
Mit starken Basen wie Natriumamid oder Butyllithium lassen sich die Wasserstoffatome durch Alkalimetalle ersetzen. Durch Substitution sämtlicher Wasserstoffatome lassen sich die sogenannten Phosphide synthetisieren.
Das Standard-Reduktionspotential beträgt in im sauren Milieu −0,063 V, im basischen −0,89 V.
Bei 150 °C entzündet sich Monophosphan in Luft und wird zu Phosphorsäure oxidiert:
Verwendung
Monophosphan wird zur Schädlingsbekämpfung, insbesondere zur Mäuse- und Insektenbekämpfung in Getreidesilos und Lagern von Pflanzenprodukten eingesetzt. Die Begasung kann durch Fachkräfte direkt mit Monophosphangas erfolgen. Häufig werden stattdessen feste Präparate (z. B. mit dem Wirkstoff Aluminiumphosphid AlP oder Calciumphosphid Ca3P2) ausgelegt, die mit der Luftfeuchtigkeit reagieren und so das Monophosphangas freisetzen.
Es wird auch bei der Herstellung von Leuchtdioden zur Dotierung von Silicium mit Phosphor verwendet. Außerdem wird es zur Synthese diverser organischer Verbindungen verwendet.
Es wurden auch schon Versuche zur Phosphordüngung mittels Monophosphan angestellt.
Sicherheitshinweise
Monophosphan ist ein sehr starkes Nerven- und Stoffwechselgift, das nicht nur bei Säugetieren, sondern auch bei Insekten schon bei niedriger Konzentration hochwirksam ist. Beim Menschen löst es Blutdruckabfall, Erbrechen, Lungenödeme und Koma aus. Außerdem ist Monophosphan durch Spuren von Diphosphan an der Luft selbstentzündlich, was die Handhabung sehr heikel macht.
Nachweis
Monophosphan lässt sich am einfachsten mit sogenannten Prüfröhrchen oder entsprechenden Sensoren nachweisen. Außerdem ist der Geruch von Phosphin (genauer gesagt, der Geruch der enthaltenen Verunreinigungen) ab einer Konzentration von 2 ppm wahrnehmbar.
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu Monophosphan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. November 2007 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 7803-51-2 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- Produkteinformationen der Firma AIR LIQUIDE
- CRC Handbook of Chemistry and Physics, 60th Edition, 1980, CRC Press, Inc.
- Hermann Römpp, Chemielexikon, fünfte Auflage, 1962, Franckh'sche Verlagshandlung
- Holleman-Wiberg, Lehrbuch der Anorganischen Chemie, hundertunderste Auflage, 1995, Walter de Gruyter & Co
- G.H. Aylward, T.J.V. Findlay, Datensammlung Chemie in SI-Einheiten, dritte Auflage, 1999, Wiley-VCH
Kategorien:- Feuergefährlicher Stoff
- Umweltgefährlicher Stoff
- Giftiger Stoff
- Wasserstoffverbindung
- Phosphorverbindung
Wikimedia Foundation.