- Retrovis
-
Strukturformel 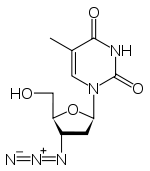
Allgemeines Freiname Zidovudin Andere Namen - Azidothymidin, AZT
- 3'-Azido-3'-desoxythymidin
- 1-[(2R,4S,5S)-4-Azido-5-hydroxymethyl- oxolan-2-yl]-5-methyl-pyrimidin-2,4-dion (IUPAC)
Summenformel C10H13N5O4 CAS-Nummer 30516-87-1 PubChem 35370 ATC-Code J05AF01
DrugBank DB00495 Kurzbeschreibung weißes bis beiges, kristallines, lichtempfindliches Pulver [1] Arzneistoffangaben Wirkstoffklasse Wirkmechanismus kompetitive Hemmung der reversen Transkriptase
Fertigpräparate Retrovir® (D)
Verschreibungspflichtig: Ja Eigenschaften Molare Masse 267,24 g·mol−1 Schmelzpunkt 124–126 °C [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 40 S: 36/37/39-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Zidovudin (auch Azidothymidin, kurz AZT) ist ein chemisches Analogon des Nukleosids Thymidin. Pharmakologisch gehört es zu den nukleosidischen Reverse-Transkriptase-Inhibitoren (NRTI), einer Gruppe von antiretroviralen Substanzen. Zidovudin wird zur Behandlung von HIV-1-infizierten Patienten im Rahmen einer antiretroviralen Kombinationstherapie eingesetzt.
Es wird unter dem Handelsnamen Retrovir® bzw. Retrovis® der Firma GlaxoSmithKline vertrieben.
Inhaltsverzeichnis
Chemie
AZT ist ein Nukleosid aus Thymin und einer modifizierten Desoxyribose mit einer Azidfunktion statt der Hydroxygruppe an 3'-Position.
Geschichte
AZT wurde erstmals 1964 von Jerome Horowitz synthetisiert, der zu dieser Zeit als Wissenschaftler an der Michigan Cancer Foundation arbeitete. Ursprüngliches Ziel war es, ein Medikament zur Behandlung von Krebs zu entwickeln, was jedoch nicht gelang. Im Februar 1985 konnte schließlich der NIH-Wissenschaftler Hiroaki Mitsuya die Wirksamkeit der Substanz gegen HIV nachweisen. Diese beruht auf der Fähigkeit des Medikaments, die Aktivität des Enzyms Reverse Transkriptase (RT) zu blockieren. Dieses Enzym nutzt das HI-Virus zur Replikation seiner RNA, also für das Umschreiben seines Genoms in DNA. Es erfüllt damit eine entscheidende Funktion bei der Vermehrung des Virus. Kurz darauf wurden die Rechte an der Substanz von dem Pharmakonzern Burroughs-Wellcome (jetzt GlaxoSmithKline) aufgekauft, der 1986 ein Patent auf AZT beantragte. Die amerikanische Food and Drug Administration (FDA) erteilte am 20. März 1987 die Zulassung für AZT als Medikament zur Behandlung von HIV; 1990 erfolgte die Zulassung als Präventionsmedikament. In den Anfängen der AZT-Behandlung wurden wesentlich höhere Dosen verabreicht, als es heute der Fall ist: Üblich waren 400 mg alle vier Stunden (sogar nachts). Aus diesem Grund kamen schwere Nebenwirkungen, u. a. Anämien, vor. Moderne Behandlungspläne sehen geringere Dosen vor, die nur zwei- bis dreimal am Tag verabreicht werden. Unter einer Monotherapie oder einer Zweierkombination werden selten mehr als 500-600 mg AZT pro Tag gegeben. Ziel ist es, die Lebensqualität des Patienten insgesamt zu verbessern. Außerdem wird AZT heute nahezu immer mit anderen Medikamenten kombiniert, um einer Mutation des HI-Virus in eine AZT-resistente Form entgegenzuwirken – es ist wesentlich unwahrscheinlicher, dass das Virus zwei Resistenzen entwickelt.
Wirkungsweise
Die Azidgruppe erhöht die lipophile Natur des AZT, so dass es leicht mittels Diffusion Zellmembranen passieren und so auch die Blut-Hirn-Schranke überwinden kann. Zelluläre Enzyme wandeln AZT in drei aufeinanderfolgenden Schritten in das wirksame 5'-Triphosphat (AZTTP) um. AZT-5'-Triphosphat entfaltet seine Wirkung nun auf zweierlei Art: als Nukleosidanalogon und somit konkurrierendes Substrat zum Thymidintriphosphat bedingt es die kompetitive Hemmung der reversen Transkriptase (RT) des HI-Virus. Durch seinen Einbau in die DNA stoppt es zum anderen die virale DNA-Synthese. Letzteres hat seine Ursache in der Abwesenheit einer 3'-Hydroxylgruppe im AZT, welches das Anfügen weiterer Nukleotide in die DNA-Kette unmöglich macht. Studien haben gezeigt, dass der Kettenabbruch der entscheidende Faktor der inhibitorischen Wirkung des AZT ist. AZT hemmt die virale RT etwa hundertmal effektiver als die zelluläre DNA-Polymerase. AZT hydrolysiert außerdem zum 3'-Amino-2'-desoxythymidin, dessen Triphosphat ein Substrat der DNA-Polymerase α ist.
Nebenwirkungen
Häufige Nebenwirkungen sind Kopfschmerzen, Übelkeit, Erbrechen, Appetitlosigkeit, Bauchschmerzen und gelegentlich auch Fieber. Schwerere Nebenwirkungen, insbesondere Anämie (Blutarmut) und Neutropenie und Leukopenie (Verminderung der weißen Blutzellen), sind von der Dosis und der individuellen Konstitution des Patienten abhängig. Da AZT heute in wesentlich geringeren Dosen verabreicht wird als zu Zeiten der Einführung des Medikaments, treten schwere Nebenwirkungen nur noch gelegentlich auf. So werden Blutarmut und Verminderung der Leukozytenzahl, insbesondere wenn AZT im Rahmen einer Dreierkombination zusammen mit einem Proteaseinhibitor eingenommen wird, nur sehr selten beobachtet.
Die beschriebenen unerwünschten Nebenwirkungen von AZT könnten in der Empfindlichkeit der DNA-Polymerase γ begründet sein; diese Polymerase ist ein Enzym in den Mitochondrien der Zellen, welches möglicherweise von AZT in seiner Funktion beeinträchtigt wird. Die mitochondriale Toxizität von AZT und die dadurch verursachten Zellschädigungen sind bereits intensiv untersucht worden.[4]
Concorde-Studie
Aufgrund der Ergebnisse der Mitte der 1990er Jahre durchgeführten großen Concorde-Studie mit 1.749 HIV-Patienten[5] musste die bis 1994 eingesetzte AZT-Dosierung erheblich reduziert werden. In dieser mehrjährigen Untersuchung (mittlere Beobachtungszeit 3,3 Jahre) wurde einer HIV-Patientengruppe sofort AZT verabreicht (877 Patienten), in einer weiteren HIV-Patientengruppe erfolgte die Behandlung aber zunächst mit Placebo und erst zu einem vergleichsweise späten Zeitpunkt mit AZT (872 Patienten). Die Concorde-Studie veränderte die mit AZT verbundenen Therapie-Erwartungen, denn in der sofort behandelten Patientengruppe kam es zu mehr Todesfällen (96:76), häufiger zu Therapieabbruch wegen schwerer Nebenwirkungen (99:38) und auch öfter zu einer Dosisreduzierung (148:37). Seit der weltweiten Verringerung der Dosierung und der Kombination von AZT mit weiteren Wirkstoffklassen Kombinationstherapie (HAART) haben sich die Überlebenschancen der HIV-Patienten wesentlich verbessert, was zumeist auf die effektivere Virusbekämpfung zurückgeführt wird.[6]
Kritik an AZT
Die anfängliche Hoffnung, mit AZT den entscheidenden Schlag gegen HIV und AIDS führen zu können, stellte sich bald als überhöht dar. Neben der - besonders bei den früher üblichen hohen Dosierungen - Toxizität machte vor allem die Resistenzentwicklung zu schaffen. Andere NRTIs (ab 1991) und andere Wirkstoffgruppen wie NNRTIs und Proteasehemmer (ab 1995) wurden daher entwickelt und die Medikamente vorzugsweise in Dreifachkombinationen im Rahmen der HAART eingesetzt. Mit diesen ist eine bessere Kontrolle der HIV-Vermehrung möglich und es können deutliche Lebensverlängerungen erzielt werden. Durch die niedrigere Dosierung von AZT stellt die Toxizität ein im Vergleich zu früher geringeres Problem dar und die Resistenzentwicklung ist in der HAART erschwert. Auch Dreifachkombinationen können jedoch HIV nicht ewig in Schach halten und auch in niedriger Dosierung ist besonders die mitochondriale Langzeittoxizität von AZT ein Problem. In manchen Situationen greift man daher bevorzugt auf neuere NRTIs wie Abacavir oder Tenofovir zurück und es bleibt abzuwarten, ob AZT nach Etablierung neuer Substanzen wie Fusionshemmern, Integrasehemmern, Korezeptorantagonisten und Maturationshemmern langfristig den Stellenwert von heute behalten wird. Im Moment stellt AZT jedoch trotz aller Probleme und Schwächen selbst nach 20 Jahren noch einen unverzichtbaren Teil vieler Regime dar, da es erwiesenermaßen wirksam ist, das am besten erforschte und am längsten bekannte HIV-Medikament darstellt und z. B. auch die Liquorgängigkeit günstig ist.
Einige Aids-Leugner behaupten trotz gesicherter wissenschaftlicher Erkenntnisse über den Zusammenhang von HIV und Aids, dass nicht HIV Aids verursacht, sondern AZT.
Herstellung
Mehrere verschiedene vielstufige Synthesen für Zidovudin, ausgehend von Thymidin, sind in der Literatur beschrieben. [7]
Einzelnachweise
- ↑ a b Hermann Ammon (Hrsg.): Hunnius pharmazeutisches Wörterbuch. 8. Auflage, de Gruyter, Berlin 2004. ISBN 3-11-015792-6
- ↑ Sicherheitsdatenblatt Sigma-Aldrich
- ↑ Zidovudin bei ChemIDplus
- ↑ Yamaguchi T, Katoh I, Kurata S. Azidothymidine causes functional and structural destruction of mitochondria, glutathione deficiency and HIV-1 promoter sensitization. Eur J Biochem. 2002 Jun;269(11):2782-8. PMID 12047388. Volltext (engl.), abgerufen am 30. September 2008.
- ↑ Concorde Coordinating Committee. Concorde: MRC/ANRS randomised double-blind controlled trial of immediate and deferred zidovudine in symptom-free HIV infection. Lancet. 1994 Apr 9;343(8902):871-81. PMID 7908356.
- ↑ http://www.hiv.net/2010/haart/historie.htm
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dietmar Reichert: Pharmaceutical Substances, 4. Auflage (2000), 2 Bände erschienen im Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
Literatur
- De Clercq, E: HIV resistance to reverse transcriptase inhibitors. In: Biochemical Pharmacology 1994; 47:155-169.
- Rang H.P., Dale M.M., Ritter J.M.: Pharmacology, 3rd edition. Pearson Professional Ltd, 1995.
- Balzarini J., Naesens L., Aquaro S., Knispel T., Perno C.-F., De Clercq E., Meier C.: Intracellular Metabolism of CycloSaligenyl 3’-Azido-2’-3’-dideoxythymidine Monophosphate, a Prodrug of 3’-Azido-2’-3’-dideoxythymidine (Zidovudine). In: Molecular Pharmacology. 1999; 56:1354-1361
- Yamaguchi T, Katoh I, Kurata S.: Azidothymidine causes functional and structural destruction of mitochondria, glutathione deficiency and HIV-1 promoter sensitization. In: Eur J Biochem. 2002 Jun;269(11):2782-8. PMID 12047388 PDF
- de la Asuncion JG, Del Olmo ML, Gomez-Cambronero LG, Sastre J, Pallardo FV, Vina J.: AZT induces oxidative damage to cardiac mitochondria: protective effect of vitamins C and E. In: Life Sci. 2004 Nov 19;76(1):47-56. PMID 15501479
- Papparella I, Ceolotto G, Berto L, Cavalli M, Bova S, Cargnelli G, Ruga E, Milanesi O, Franco L, Mazzoni M, Petrelli L, Nussdorfer GG, Semplicini A.: Vitamin C prevents zidovudine-induced NAD(P)H oxidase activation and hypertension in the rat. In: Cardiovasc Res. 2007 Jan 15;73(2):432-8. PMID 17123493
- Feola DJ, Garvy BA.: Combination exposure to zidovudine plus sulfamethoxazole-trimethoprim diminishes B-lymphocyte immune responses to Pneumocystis murina infection in healthy mice. In: Clin Vaccine Immunol. 2006 Feb;13(2):193-201. PMID 16467325
- Collier AC, Helliwell RJ, Keelan JA, Paxton JW, Mitchell MD, Tingle MD.: 3'-azido-3'-deoxythymidine (AZT) induces apoptosis and alters metabolic enzyme activity in human placenta. In: Toxicol Appl Pharmacol. 2003 Oct 15;192(2):164-73. PMID 14550750
- Benveniste O, Estaquier J, Lelievre JD, Vilde JL, Ameisen JC, Leport C.: Possible mechanism of toxicity of zidovudine by induction of apoptosis of CD4+ and CD8+ T-cells in vivo.. In: Eur J Clin Microbiol Infect Dis. 2001 Dec;20(12):896-7 PMID 11837644
- Walker UA: Mitochondriale Toxizität von Nukleosidanaloga. hiv.net
- Mondal D, Pradhan L, Ali M, Agrawal KC.: HAART drugs induce oxidative stress in human endothelial cells and increase endothelial recruitment of mononuclear cells: exacerbation by inflammatory cytokines and amelioration by antioxidants. In: Cardiovasc Toxicol. 2004;4(3):287-302. PMID 15470276
- de la Asuncion JG, del Olmo ML, Sastre J, Millan A, Pellin A, Pallardo FV, Vina J.: AZT treatment induces molecular and ultrastructural oxidative damage to muscle mitochondria. Prevention by antioxidant vitamins. In: J Clin Invest. 1998 Jul 1;102(1):4-9. PMID 9649550
- Garcia-de-la-Asuncion J, Gomez-Cambronero LG, Olmo ML, Pallardo FV, Sastre J, Vina J.: Vitamins C and E prevent AZT-induced leukopenia and loss of cellularity in bone marrow. Studies in mice. In: Free Radic Res. 2007 Mar;41(3):330-4. PMID 17364962
- Concorde: MRC/ANRS randomised double-blind controlled trial of immediate and deferred zidovudine in symptom-free HIV infection. Concorde Coordinating Committee. In: Lancet. 1994 Apr 9;343(8902):871-81. PMID 7908356
- Torsten Engelbrecht und Claus Köhnlein: Virus-Wahn, 3.Auflage 2006, S.133-146
Wikimedia Foundation.
