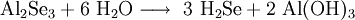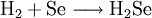- SeH2
-
Strukturformel 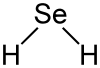
Allgemeines Name Selenwasserstoff Andere Namen - Hydrogenselenid
- Dihydrogenselenid
Summenformel H2Se CAS-Nummer 7783-07-5 PubChem 533 Kurzbeschreibung farbloses, äußerst giftiges Gas mit unangenehm fauligem Geruch Eigenschaften Molare Masse 80,98 g·mol−1 Aggregatzustand gasförmig
Dichte 3,6607 g/l (0 °C, 1013 hPa)
1,974 g·cm−3 (flüssig, am Siedepunkt)[1]Schmelzpunkt −66 °C[1]
Siedepunkt −41 °C (Zersetzung oberhalb von 150 °C)[1]
Dampfdruck 9,12 bar bei 20 °C[1]
Löslichkeit löslich in Wasser (9,8 g/l)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Hoch-
entzündlichSehr giftig (F+) (T+) R- und S-Sätze R: 12-26 S: (1)-9-16-33-36-45 MAK 0,015 ml·m−3[1]
WGK 3[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Selenwasserstoff, auch Monoselan, ist eine Verbindung aus Selen und Wasserstoff. Sie entsteht bei der Auflösung salzartiger Selenide in verdünnten Säuren. Selenwasserstoff ist ein farbloses, äußerst giftiges Gas mit unangenehm fauligem Geruch. Bereits die einmalige Einatmung kleiner Mengen führt zu unangenehmen, lange anhaltenden Reizungen der Schleimhäute (sog. „Selenschnupfen“). Selenwasserstoff ist noch giftiger als Schwefelwasserstoff.
Selenwasserstoff dient in der Halbleiter- und Elektronikindustrie zur Dotierung von Halbleitern.
Inhaltsverzeichnis
Physikalische Eigenschaften
 Selenwasserstoff ist gewinkelt aufgebaut (Bindungswinkel 91 °), die Bindungslänge Se–H beträgt 146 pm.[2]
Selenwasserstoff ist gewinkelt aufgebaut (Bindungswinkel 91 °), die Bindungslänge Se–H beträgt 146 pm.[2]- Kritische Temperatur: 138 °C
- Kritischer Druck: 89,17 bar
- Kritische Dichte: 0,76 kg/l
- Tripelpunkt Temperatur: −65,65 °C
- Tripelpunkt Druck: 0,2738 bar
Herstellung
Zu reinem Selenwasserstoff führt im Labor das Auflösen von trockenem Aluminiumselenid in Wasser, oder eine Reaktion der Elemente bei 400 °C:[3]
Weblinks
Quellen
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 7783-07-5 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30.08.2007 (JavaScript erforderlich)
- ↑ Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 627
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 418-9.
Wikimedia Foundation.