- Suzukikupplung
-
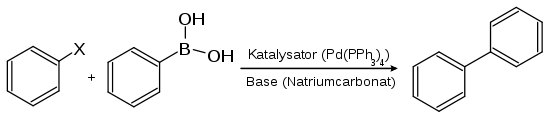
Die Suzuki-Kupplung ist in der organischen Chemie eine Reaktion zur Bildung von Biphenylderivaten oder Vinylaromaten durch Kreuzkupplung. Hierbei werden Arylboronsäuren mit Halogenaromaten unter katalytischer Verwendung von Palladium-Phosphan-Komplexen umgesetzt. Sie ist mit der Heck-Reaktion eng verwandt und besitzt dementsprechend einen ähnlichen Reaktionsmechanismus. Entdeckt wurde sie 1979 von Akira Suzuki.[1]
Inhaltsverzeichnis
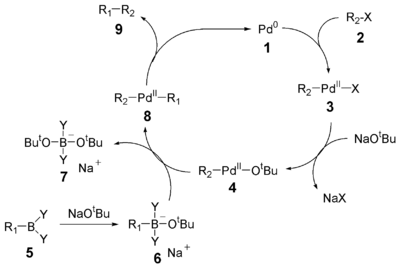
Mechanismus
In den Anfängen der Suzuki-Kupplung konnten mit Hilfe von Tetrakis(Triphenylphosphin)Palladium(0), Pd(PPh3)4, als Katalysator lediglich Halogenaromaten mit hoher Reaktivität – aufsteigend von Brom über OTf (Ester der Trifluormethansulfonsäure) nach Iod – umgesetzt werden. Schwach reaktive Chloraromaten können erst in den letzten Jahren mit speziellen Palladium-Phosphan-Katalysatoren zur Reaktion gebracht werden. Ebenso ist es gelungen, unaktivierte Alkylbromide bei Raumtemperatur umzusetzen, ohne dass es zu einer beta-Hydrideliminierung kommt.
Als Basen für die Reaktion können neben Natriumcarbonat auch Natronlauge (NaOH), Natriumethanolat (NaOEt), Natriumphosphat (Na3PO4) und ähnliche verwendet werden.
Zur Vereinfachung der Aufarbeitung wurden darüber hinaus die Katalysatorliganden vielfach modifiziert, um das Arbeiten in leicht trennbaren Mehrphasensystemen (z. B. wässrig/organisch; organisch/perfluoriert) zu ermöglichen.
Neben der Suzuki-Kupplung existieren weitere palladiumkatalysierte Kupplungsreaktionen, sie unterscheiden sich lediglich im Einsatz der Metallorganyle. So wird bei der Stille-Kupplung anstatt von Bororganylen auf Organozinnverbindungen zurückgegriffen, die aufgrund ihrer hohen Toxizität schwer zu handhaben sind.
Anwendungen
Die Suzuki-Kupplung hat ihre größte Bedeutung in der Synthese von Naturstoffen. Als Beispiel sie hier die Synthese des Antibiotikums Vancomycin oder des Fungizids Boscalid angeführt. Borverbindungen sind weniger giftig als Verbindungen alternativer Verfahren. Auch in der Synthese von Flüssigkristallen, welche meist aus Biphenylstrukturen bestehen, kann die Suzuki-Kupplung enormen synthetischen Aufwand ersparen, da sie sehr selektiv ist.
Siehe auch
Quellen
- Elschenbroich, C.; Organometallchemie, 5. Auflage, Teubner Verlag, Wiesbaden, 2005. ISBN 3-519-53501-7
- Suzuki, A.; P.J. Stang (Ed.), F. Diedrich (Ed.); Metal-Catalyzed Cross-coupling Reactions, Wiley-VCH, Weinheim 1998.
Einzelnachweise
- ↑ Norio Miyaura und Akira Suzuki: Stereoselective synthesis of arylated (E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst. In: J. Chem. Soc., Chem. Commun. 1979, S. 866-867;
Norio Miyaura, Kinji Yamada und Akira Suzuki: A new stereospecific cross-coupling by the palladium-catalyzed reaction of 1-alkenylboranes with 1-alkenyl or 1-alkynyl halides. In: Tetrahedron Letters. 1979, S. 3437.
Weblinks
Wikimedia Foundation.