- Kreuzkupplung
-
Unter Kreuzkupplungen versteht man Kupplungsreaktionen zwischen zwei unterschiedlichen Molekülen, bei denen metallorganisch katalysiert Kohlenstoff-Kohlenstoff-Bindungen geknüpft werden.
Inhaltsverzeichnis
Bedeutung
Die Kreuzkupplung ist ein wichtiges Werkzeug in der präparativen organischen Chemie und hat hier ganz besondere Bedeutung in der Synthese von Wirkstoff-Bibliotheken, um Struktur-Wirkungs-Beziehungen (SAR) zu untersuchen.
Die hier verwendeten metallorganischen Verbindungen und Komplexe sind relativ einfach über Metallierung, Transmetallierung oder Halogen-Metall-Austausch bzw. Insertation in eine Halogen-Kohlenstoff-Bindung herzustellen. Die meisten Kreuzkupplungen sind Übergangsmetall-katalysierte Reaktion. Hier haben besonders die Platinelemente wie Palladium und Platin eine herausragende Bedeutung. Aber auch vergleichsweise preiswerte Metalle wie Eisen finden hier ihre Anwendung.
Geschichte
Bis in die 1960er Jahre waren ausschließlich Kupplungsreaktionen vom Wurtz-Fittig-Typ bekannt. Dabei wird eine metallorganische Verbindung mit einem Halogenid unter Bildung des Kupplungsproduktes und der Abspaltung des entsprechenden Metallhalogenid zur Reaktion gebracht. Hier haben Lithium- und Magnesium-organische Verbindungen besondere Bedeutung. Die Reaktionen werden normalerweise nicht katalysiert, sondern sind stöchiometrische Reaktionen. Diese alten unkatalysierten Kupplungen sind jedoch auf wenige Substrate wie Alkyl-, Allyl- und Benzyl-halogenide eingeschränkt. Die Umsetzung mit z.B. Vinyl- oder Phenyl-halogeniden ist so nicht möglich, und die Ausbeuten dieser Art Kupplungen ist häufig recht bescheiden. Dadurch hat dieser Typ an Kreuzkupplungen kaum Bedeutung erlangt.
Erst mit der Stephens-Castro-Kupplung wurde im Jahr 1963 der Prototyp der modernen Kreuzkupplung entdeckt. Bei dieser unkatalysierten Kupplung wird ein Kupferacetilid in einer Aryl-Acetylen-Kupplung umgesetzt.
Im Jahre 1972 wurde von Kumada die nach ihm benannte Kupplungsreaktion entdeckt.[1][2][3][4] Bei dieser Nickelphosphin- oder Palladiumphosphin-Komplexe katalysierten Reaktion werden im Sinne einer Wurtz-Fittig-Kupplung Grignard-Verbindungen mit Alkenyl- bzw. Arylhalogeniden gekuppelt. Im heutigen Sinne handelt es sich aber um keine Kreuzkupplung da die gezielte Kupplung zweier verschiedener Reaktionspartner noch schwer zu steuern war.
Später, im Jahr 1977 wurde von Ei-ichi Negishi die erste echte Kreuzkupplung mit der nach ihm benannten Reaktion publiziert.[5] Bei dieser Kupplung zwischen einem Arylhalogenid und einem Zinkorganyl werden unter Nickel- oder Palladium-Katalyse unsymmetrische Biaryl-Verbindungen hergestellt. Damit war der Grundstein zu den heutigen Kreuzkupplungen gelegt. Es folgten dann weitere Typen von Kreuzkupplungen, die allesamt heute immer noch ihre Bedeutung haben und die klassischen Kupplungsreaktionen praktisch bedeutungslos gemacht haben.
Negishi, Richard Fred Heck und Akira Suzuki wurden im Jahr 2010 für ihre Arbeit an Kreuzkupplungen mit dem Nobelpreis für Chemie ausgezeichnet.
Palladium-, Platin-, und Nickel-katalysierte Kreuzkupplungen
Die meisten der Kreuzkupplungen, die heute noch eine Bedeutung haben, sind Palladium-, Platin- oder Nickel-katalysiert – wobei dort auch wieder Palladium (z.B. in Form von CataCXium F sulf-Palladiumkomplexen) die größte Bedeutung hat. Bei industriellen Prozessen ist man jedoch versucht, auf preiswertere Metalle als Katalysator auszuweichen.
Reaktionsmechanismus
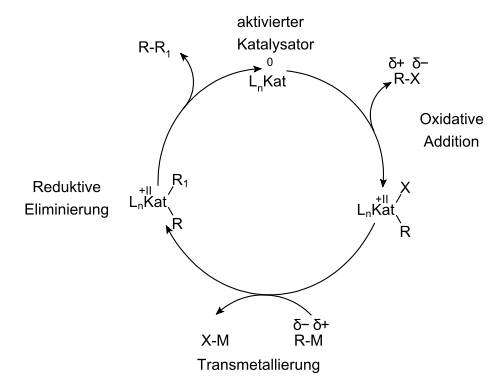
Die heutige Vorstellung über den Mechanismus der Kreuzkupplungsreaktion ist für alle Reaktionstypen gleich. Während des Katalysecyclus wechselt das Metallatom zweifach seine Oxidationsstufe. Damit eine asymmetrische Kupplung möglich ist, müssen beide Reaktionspartner unterschiedlich aktiviert sein. Normalerweise ist einer der Reaktionspartner mit einer Abgangsgruppe versehen, in dessen Bindung mit dem Kohlenstoff-Atom das Metallatom des Katalysators über eine Oxidative Addition insertieren kann. Im nächsten Schritt erfolgt eine Transmetallierung der Organometall-Verbindung mit dem Katalysator-Substrat-Komplex. Durch eine Reduktive Eliminierung wird der Katalysator in der ursprünglichen Oxidationsstufe freigesetzt und dabei das Kupplungsprodukt gebildet.
Kat = Pd, Pt, Ni
X = Abgangsgruppe
R = Aryl, Alkenyl, Acetylenyl
Beispiele
Hiyama-Kupplung
- M = SiR''3
Kumada-Kupplung
- M = MgX
Problematisch bei der Anwendung der Kumada-Kupplung kann die starke Basizität des Reagenzes sein. Daher können basenempfindliche Substrate meist nicht eingesetzt werden, viele funktionelle Gruppen werden nicht toleriert, so z.B. Ketone und Aldehyde, die mit dem Reagenz Additionsreaktionen eingehen (siehe auch: Grignard-Reaktion).
Negishi-Kupplung
- M = ZnR''
Die Negishi-Kupplung toleriert viele funktionelle Gruppen am Substrat. Sie ist eine sehr milde Methode und wird daher häufig eingesetzt. (Möglicher Nachteil: Das Reagenz muss aus der jeweiligen iodierten Spezies herstellbar sein. Dies ist eine großtechnisch aufwendige, weil viel Energie benötigende Methode.)
Stille-Kupplung
- M = SnR''3
Die Stille-Kupplung toleriert ebenfalls viele funktionelle Gruppen am Substrat, sie ist die mildeste der vorgestellten Methoden. Das Reagenz ist neutral gegenüber Brønsted-Säuren und -Basen. Problematisch ist jedoch die Toxizität des Reagenzes, so wie bei den meisten Organozinn-Verbindungen (s. TBT).
Suzuki-Kupplung
- M = B(OH)2,B(OR'')2
Die Suzuki-Kupplung stellt die am weitesten entwickelte Methode der Kreuzkupplung dar. Auch wenn das (meistens ungiftige)Reagenz leicht basisch ist, werden die meisten funktionellen Gruppen toleriert.
Der große Vorteil dieser Methode ist, dass auch Reste R und R' über sp³-hybridisierte Kohlenstoffe verknüpft werden können.
Ausnahmen
Cacchi- und Sonogashira-(Hagihara)-Kreuzkupplungen
Das Prinzip von Cacchi- und Sonogashira-(Hagihara)-Kreuzkupplungen ist den bereits genannten Kreuzkupplungen verwandt, so werden ebenfalls olefinische oder aromatische Substrate an einem Palladium-Komplex miteinander verknüpft. Sie verlaufen jedoch über einen völlig anderen Mechanismus, der im gleichnamigen Artikel beschrieben ist.
Heck-Reaktion
Die Heck-Reaktion ist eine wichtige organisch-chemische Namensreaktion zur palladiumkatalysierten Herstellung von Arylolefinen. Sie ist aufgrund ihres speziellen Mechanismus keine klassische Kreuzkupplung i.e.S. und wird hier daher nicht einzeln behandelt, wird jedoch aufgrund ihrer Fähigkeit, durch C-C-Bindungsknüpfung zwei unterschiedliche Substrate zu verknüpfen, hier aufgeführt.
Cu-katalysierte Kreuzkupplungen
Als Kupfer-katalysierte Kreuzkupplungen sind zu nennen:
- Stephens-Castro-Kupplung: Herstellung von Arylalkinen aus Aryliodiden und terminalen Alkinen
- Ullmann-Kupplung (s. Artikel organische Kupferverbindungen, Punkt 5.3)
- Glaser-Kupplung (s. Artikel organische Kupferverbindungen, Punkt 5.3)
- Cadiot-Chodkiewicz-Kupplung: Herstellung konjugierter Diine aus einem terminalen Alkin und einem Bromalkin
Siehe auch
- Heck-Reaktion
- Negishi-Kupplung
- Suzuki-Kupplung
- Hiyama-Kupplung
- Sonogashira-Kupplung
- Ullmannreaktion
- Stille-Kupplung
- Kumada-Kupplung (auf Grignardreagenzien basierend)
Einzelnachweise
- ↑ K. Tamao, K. Sumitani, M. Kumada, J. Am. Chem. Soc., 1972, 94, 4374.
- ↑ R. J. P. Corriu, J. P. Masse, J. Chem. Soc. Chem. Commun., 1972, 144.
- ↑ K. Tamao, K. Sumitani, Y. Kiso, M. Zembayashi, A. Fujioka, S. Kodama, I. Nakajima, A. Minato, M. Kumada, Bull. Chem. Soc. Jpn., 1976, 49, 1958.
- ↑ D. G. Morell, J. K. Kochi, J. Am. Chem. Soc., 1976, 97, 7262.
- ↑ E. Negishi et al. J. Am. Chem. Soc. 1987, 109, 2393.
Weblinks
Im Portal für organische Chemie:
Pd-, Pt-, Ni-katalysierte Kreuzkupplungen
Cu-katalysierte Kreuzkupplungen
Wikimedia Foundation.