- Triaminotrinitrobenzol
-
Strukturformel 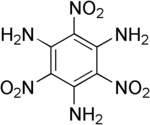
Allgemeines Name Triaminotrinitrobenzol Andere Namen - TATB
- 1,3,5-Triamino-2,4,6-trinitrobenzol
- 2,4,6-Trinitro-1,3,5-benzentriamin
- 1,3,5-Triamino-2,4,6-trinitrobenzen
Summenformel C6H6N6O6 CAS-Nummer 3058-38-6 PubChem 18286 Kurzbeschreibung gelbe Kristalle[1]
Eigenschaften Molare Masse 258,15 g·mol−1 Aggregatzustand fest
Dichte 1,94 g·cm−3[1]
Schmelzpunkt Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Triaminotrinitrobenzol (kurz TATB) ist eine als Sprengstoff verwendete aromatische Nitroverbindung.
Inhaltsverzeichnis
Geschichte
TATB wurde von Jackson und Wing 1888 erstmals synthetisiert. In den 1950er-Jahren wurde in den Naval Ordnance Laboratories (USA) die Stabilität und Unempfindlichkeit von TATB erkannt und es wurden effiziente Syntheseverfahren mit hoher Ausbeute entwickelt. In den 1970er-Jahren wurde TATB vor allem in den USA eingehend untersucht und charakterisiert.
Darstellung
Zur Synthese von Triaminotrinitrobenzol gibt es verschiedene Möglichkeiten:
- Nitrierung von 1,3,5-Trichlorbenzol (C6H3Cl3) mit Nitriersäure und anschließender Behandlung mit Ammoniak in Alkohol
- Reduktion von Trinitrotoluol (C7H5N3O6) mit Schwefelwasserstoff (H2S) in Dioxan. Dabei entsteht 6-Amino-2,4-dinitrotoluol (C7H7N3O4). Dies wird anschließend mit Nitriersäure zu Pentanitroanilin umgesetzt, dann mit Ammoniak in Dichlormethan zu TATB.
- Beim VNS-Verfahren (Vicarious Nucleophilic Substitution) wird Pikramid (Trinitroanilin) (C6H4N4O6) mit 1,1,1-Trimethylhydraziniumiodid (TMHI) (C3H11N2I) in Gegenwart von Natriummethylat in Dimethylsulfoxid direkt zu TATB umgesetzt. Anstelle von TMHI ist auch die Verwendung von 1,1,1-Triethylhydraziniumchlorid oder 4-Amino-1,2,4-triazol beschrieben.
Zur Reinigung wird aus Dimethylsulfoxid und Diphenylether umkristallisiert.
Eigenschaften
TATB bildet gelbe, trikline Kristalle.[1]
Die Stabilität von TATB wird durch intermolekulare und intramolekulare Wasserstoffbrücken erklärt, welche sich infolge der alternierenden Nitro- und Aminogruppen um den Benzolring herum ausbilden.
Verwendung
TATB wird trotz seiner hohen Herstellungskosten von rund 100,– €/kg[1] als Sprengstoff eingesetzt, da die Verbindung einerseits stabil und damit gut zu handhaben ist, andererseits aber eine hohe Sprengkraft besitzt. Die Beständigkeit von TATB gegen Stoß- und Hitzeeinwirkung ist größer als die eines jeden anderen bekannten Materials mit vergleichbarer Energiedichte. TATB wird selbst durch den Aufschlag bei Flugzeugabstürzen, Feuer, Explosionen oder den Einschlag von Geschossen aus Handfeuerwaffen nicht zur Explosion gebracht. Wegen dieser Eigenschaften wird TATB z. B. in Atombomben ("Nukleare Gefechtsköpfe") oder in Munition für Schiffe und U-Boote verwendet.
Detonationen in Sprengstoffen auf TATB-Basis verlaufen anders als Detonationen von empfindlichen Sprengstoffen: Sie sind zwar schnell, aber nicht verzögerungsfrei und zeigen eine vergleichsweise breite, dreidimensionale Reaktionszone hinter der Detonationsfront. Solche nichtidealen Detonationen können auf der Basis einfacher Theorien nicht hinreichend genau berechnet werden. Die Verwendung von TATB in Waffensystemen erfordert daher ein hochentwickeltes Verständnis der Physik und Chemie von Initiierung und Detonation.
- Detonationsgeschwindigkeit bei maximaler Dichte: 7619 m·s−1[1]
- Detonationsdruck: 25,9 GPa[1]
- Reibempfindlichkeit: >353 N[1]
- Schlagempfindlichkeit: 50 J[1]
TATB ist außerdem Bestandteil von verschiedenen Mischsprengstoffen, wie zum Beispiel LX-17 (LX = Livermore explosive)
Rechtliche Bestimmungen
Herstellung und Verarbeitung von TATB sind in Deutschland durch das Sprengstoffgesetz geregelt.
Einzelnachweise
- ↑ a b c d e f g h i Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
Literatur
- Philip F. Pagoria, Gregory S. Lee, Alexander R. Mitchell, Robert D. Schmidt: A Review of Energetic Materials Synthesis, in: Thermochimica Acta, 2002, 384 (1–2), S. 187–204; doi:10.1016/S0040-6031(01)00805-X.
Siehe auch
Wikimedia Foundation.
