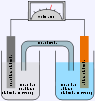
- Vanadium-Redox-Akkumulator
-
Der Vanadium-Redox-Akkumulator (Vanadium-Redox-Flussbatterie, VRFB) ist ein wiederaufladbarer Typ eines Flussakkumulators. Da er mit je einem Vanadium-Redoxpaar pro Halbzelle arbeitet, wird das Problem einer gegenseitigen Verunreinigung in Folge von Diffusionseffekten durch die Membran verhindert. Obwohl die Verwendung von Vanadiumredoxpaaren in Flussakkumulatoren bereits 1978 von Pissoort[1], NASA-Mitarbeitern, Pellegri und Spaziante[2] vorgeschlagen wurde, fand eine erfolgreiche Demonstration und kommerzielle Entwicklung erst in den 1980ern an der University of New South Wales durch Maria Skyllas-Kazacos und ihren Mitarbeiter statt.[3] Der Vanadium-Redox-Akkumulator in seiner gegenwärtigen Form (mit Schwefelsäure-Elektrolyten) wurde 1986 von der University of New South Wales in Australien patentiert[4]. Die ursprünglichen Patente liefen 2006 aus, was einen freien Markt ermöglichte[5] und zu kommerziellen Entwicklungen führte.
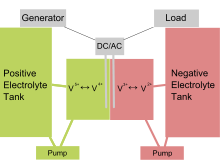 Prinzipaufbau einer Vanadium-Redox-Flussbatterie mit außen liegenden Vorrattanks. In der Mitte die eigentliche galvanische Zelle, darüber zusätzliche Wechselrichter zur Erzeugung von Wechselspannung.
Prinzipaufbau einer Vanadium-Redox-Flussbatterie mit außen liegenden Vorrattanks. In der Mitte die eigentliche galvanische Zelle, darüber zusätzliche Wechselrichter zur Erzeugung von Wechselspannung.
Der Vanadium-Redox-Akkumulator nutzt die Fähigkeit von Vanadium aus, in Lösung vier verschiedene Oxidationsstufen annehmen zu können, so dass statt zweien nur ein elektroaktives Element für den Akkumulator benötigt wird. Die Nennspannung pro Zelle liegt ohne Belastung im Bereich von 1,15 V bis 1,55 V. Bei 25 °C beträgt sie 1,41 V.
Der Hauptvorteil des Vanadium-Redox-Akkumulators ist, dass Leistung und Energie im Gegensatz zu gewöhnlichen Sekundärzellen unabhängig ist. Dies ermöglicht einer Batterie durch modularen Aufbau beliebig hohe Leistung und Kapazität. Die Leistung ist v.a. durch die Elektrodenfläche, die Speicherkapazität durch die Vanadiummenge im Elektrolyten regulierbar. Der Akkumulator kann lange Zeit komplett entladen sein, ohne dass es dabei zu nennenswerten Alterungseffekten kommt. Auch ist eine Tiefentladung problemlos. Er kann bei Bedarf durch Austausch der Elektrolyte schnell wiedergeladen werden (nachtanken), was ihn auch zur Option für mobile Anwendungen macht. Im Falle eines versehentlichen Mischens der Elektrolyte mit der anderen Halbzelle oder bei Vanadium-Diffusion durch die Trennmembran (Selbstentladung) entsteht kein permanenter Schaden, da die unterschiedlichen Oxidationsstufen wiederhergestellt werden können.
Der Hauptnachteil der Vanadium-Redox-Akkumulator-Technologie sind das noch schlechte Volumen-Energiespeicher-Verhältnis und das im Vergleich zu Standard-Akkumulatoren komplexe Gesamtsystem bestehend aus Pumpen und Vorrattanks.
Die wenigen momentan erhältlichen kommerziellen Batterien werden v.a. im stationären Bereich bei regenerativen Energiequellen für die Abdeckung von Spitzenlast, Lastausgleich und im Bereich unterbrechungsfreie Stromversorgungen verwendet.[6] Weiter erforscht werden momentan kostengünstige Membranen als Alternative zum teuren Nafion.[7] und hochkonzentrierte über weite Temperaturbereiche stabile Elektrolyte[8] Auch werden Katalysatoren zur Verringerung der Austauschstromdichte und damit zur Effizienzsteigerung entwickelt.
Weblinks
- Pressebericht vom Juni 2008
- Seite zum Vanadium-Redox-Akkumulator (engl.)
- Kommerzieller österreichischer Hersteller mit Daten
Einzelnachweise
- ↑ P. A. Pissoort, im französischen Patent Nummer 754065 (1933).
- ↑ A. Pelligri und P. M. Spaziante, im britischen Patent Nummer 2030349 (1978) der Oronzio de Nori Impianti Elettrochimici S.p.A.
- ↑ M. Rychcik und M. Skyllas-Kazacos, J. Power Sources, 22 (1988) 59-67.
- ↑ M. Skyllas-Kazacos, M. Rychcik und R. Robins, im australischen Patent Nummer 575247 (1986), der Unisearch Ltd.
- ↑ Spelters, Oliver (2010): Betrachtung zur Dynamik von Redox-Flow-Zellen, München: Grin
- ↑ M. Skyllas-Kazacos, M. H. Chakrabarti, S. A. Hajimolana, F. S. Mjalli, and M. Saleem, J. Electrochem. Soc., Volume 158, Issue 8, pp. R55-R79 (2011)
- ↑ H. Zhang, et al. Energy & Environmental Science, 2011, 4, 1676
- ↑ Li, L., Kim, S., Wang, W., Vijayakumar, M., Nie, Z., Chen, B., Zhang, J., Xia, G., Hu, J., Graff, G., Liu, J. and Yang, Z. (2011), Adv. Energy Materials, 1: 394–400.
Primärzellen: Alkali-Mangan-Batterie | Lithiumbatterie | Lithium-Eisensulfid-Batterie | Lithium-Mangandioxid-Batterie | Lithium-Thionylchlorid-Batterie | Lithium-Schwefeldioxid-Batterie | Lithium-Kohlenstoffmonofluorid-Batterie | Nickel-Oxyhydroxid-Batterie | Quecksilberoxid-Zink-Batterie | Silberoxid-Zink-Batterie | Zink-Braunstein-Zelle | Zinkchlorid-Batterie | Zink-Luft-Batterie
Sekundärzellen: Bleiakkumulator | Natrium-Schwefel-Akkumulator | Nickel-Cadmium-Akkumulator | Nickel-Eisen-Akkumulator | Nickel-Lithium-Akkumulator | Nickel-Metallhydrid-Akkumulator | Nickel-Wasserstoff-Akkumulator | Nickel-Zink-Akkumulator | Lithium-Eisen-Phosphat-Akkumulator | Lithium-Ionen-Akkumulator | Lithium-Mangan-Akkumulator | Lithium-Polymer-Akkumulator | Lithium-Schwefel-Akkumulator | Silber-Zink-Akkumulator | STAIR-Zelle | Vanadium-Redox-Akkumulator | Zink-Brom-Akkumulator | Zebra-Batterie | Zellulose-Polypyrrol-Zelle | Zinn-Schwefel-Lithium-Akkumulator
Historische Zellen: Daniell-Element | Gravity-Daniell-Element | Leclanché-Element | Voltasche Säule | Clark-Normalelement | Weston-Normalelement | Zambonisäule
Ausführungen: Akkumulator | Batterie | Brennstoffzelle | Knopfzelle | Konzentrationselement | Redox-Flow-Zelle | Thermalbatterie | Bestandteile: Halbzelle (Donator- und Akzeptorhalbzelle)
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Redox-Flow-Zelle — Die (Redox )Flussbatterie oder Redox Flow Zelle (Red für Reduktion = Elektronenaufnahme, Ox für Oxidation = Elektronenabgabe) ist ein Akkumulator und speichert elektrische Energie in chemischen Verbindungen, wobei die Reaktionspartner in einem… … Deutsch Wikipedia
Redox-Flow-Batterie — Die Redox Flow Zelle (Red für Reduktion = Elektronenaufnahme, Ox für Oxidation = Elektronenabgabe) speichert elektrische Energie in chemischen Verbindungen wie bei klassischen Akkumulatoren, hier jedoch in flüssiger Form. Die zwei… … Deutsch Wikipedia
Redox-Flow-Batterien — Die Redox Flow Zelle (Red für Reduktion = Elektronenaufnahme, Ox für Oxidation = Elektronenabgabe) speichert elektrische Energie in chemischen Verbindungen wie bei klassischen Akkumulatoren, hier jedoch in flüssiger Form. Die zwei… … Deutsch Wikipedia
Akkumulator (Elektrotechnik) — 12 V „Autobatterie“ aus sechs Sekundärzellen Ni MH Akkumulator im Standardformat „AA“ … Deutsch Wikipedia
Akkumulator — Ein Akku bzw. Akkumulator (lateinisch Sammler, Plural: Akkus oder Akkumulatoren) ist ein wiederaufladbarer Speicher für elektrische Energie auf elektrochemischer Basis, und damit eine Ausführungsform galvanischer Zellen. Akkumulatoren können … Deutsch Wikipedia
Vanadium — Eigenschaften … Deutsch Wikipedia
Lithium-Akkumulator — Lithium Ionen Akkumulator von VARTA 1000 mAh Lithium Ionen Akkumulator Ein Lithium Ionen Akkumulator (auch Lithium Ionen Akku, Li Ionen Akku, Li Ionen Sekundärbatterie … Deutsch Wikipedia
Blei-Akkumulator — Bei einem Bleiakkumulator (kurz Bleiakku) handelt es sich um eine Ausführung des Akkumulators, bei der die Elektroden im geladenen Zustand aus Blei und Bleidioxid und der Elektrolyt aus verdünnter Schwefelsäure besteht. Bleiakkumulatoren gelten… … Deutsch Wikipedia
Blei-Gel-Akkumulator — Bei einem Bleiakkumulator (kurz Bleiakku) handelt es sich um eine Ausführung des Akkumulators, bei der die Elektroden im geladenen Zustand aus Blei und Bleidioxid und der Elektrolyt aus verdünnter Schwefelsäure besteht. Bleiakkumulatoren gelten… … Deutsch Wikipedia
Lithium-Titanat-Akkumulator — Dieser Artikel wurde aufgrund von Mängeln auf der Qualitätssicherungsseite der Redaktion Chemie eingetragen. Dies geschieht, um die Qualität der Artikel aus dem Themengebiet Chemie auf ein akzeptables Niveau zu bringen. Dabei können Artikel… … Deutsch Wikipedia