- Lithium-Ionen-Akkumulator
-
Ein Lithium-Ionen-Akkumulator (auch Lithium-Ionen-Akku, Li-Ion-Akku, Li-Ionen-Sekundärbatterie, Lithium-Akkumulator oder kurz Li-Ion; [ˈliːtiʊm][1], oft fälschlich [ˈliːtsiʊm] ausgesprochen, also mit s-Laut) ist ein Akkumulator auf der Basis von Lithium. Der Li-Ionen-Akku zeichnet sich durch hohe Energiedichte aus. Er ist thermisch stabil und unterliegt keinem Memory-Effekt.[2] Weiterentwicklungen des Li-Ionen-Akkus sind der Lithium-Polymer-Akku, der Lithium-Titanat-Akku, die Super Charge Ion Battery [3], der Lithium-Luft-Akkumulator, der Lithium-Mangan-Akkumulator, der Lithium-Eisen-Phosphat-Akkumulator, der Lithium-Eisen-Mangan-Phosphat-Akkumulator, der Lithium-Eisen-Yttrium-Phosphat-Akkumulator und der Zinn-Schwefel-Lithium-Ionen-Akkumulator.[4]
Inhaltsverzeichnis
Prinzip
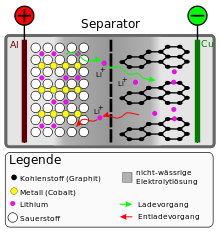
Im Lithium-Ionen-Akku wird die elektrische Energie in Lithium-Atomen (an der negativen Elektrode) und (zumeist) Übergangsmetall-Ionen (an der positiven Elektrode) in einem chemischen Prozess mit Stoffänderung gespeichert. Das unterscheidet den Li-Ion-Akku vom Lithium-Ionen-Kondensator, bei dem die Speicherung der elektrischen Energie ohne Stoffänderung erfolgt. Im Li-Ion-Akku kann Lithium in ionisierter Form durch den Elektrolyten zwischen den beiden Elektroden hin- und herwandern. Daher kommt auch der Name des Lithium-Ionen-Akkus. Im Gegensatz zu den Lithium-Ionen sind die Übergangsmetall-Ionen ortsfest.
Dieser Lithium-Ionen-Fluss ist zum Ausgleich des externen Stromflusses beim Laden und Entladen nötig, damit die Elektroden selbst (weitgehend) elektrisch neutral bleiben. Beim Entladen geben Lithium-Atome an der negativen Elektrode jeweils ein Elektron ab, welches über den externen Stromkreis zur positiven Elektrode fließt. Gleichzeitig wandern gleich viele Lithium-Ionen durch den Elektrolyten von der negativen zur positiven Elektrode. An der positiven Elektrode nehmen aber nicht die Lithium-Ionen das Elektron wieder auf, sondern die dort vorhandenen und im geladenen Zustand stark ionisierten und daher recht „elektronenhungrigen“ Übergangsmetallionen. Je nach Akkutyp können das Kobalt-, Nickel-, Mangan-, Eisen-Ionen usw. sein. Das Lithium liegt im entladenen Zustand an der positiven Elektrode somit weiterhin in Ionen-Form vor.
Da an der negativen Elektrode das Lithium nicht ionisiert ist, wäre es optimal, die negative Elektrode aus Lithium-Metall zu konstruieren. Das ist in der Praxis jedoch problematisch: Aufgrund der Deckschichtbildung wird Lithium nicht als kompaktes Metall, sondern dendritisch abgeschieden. Dieser fein verteilte Lithium-Schwamm ist hoch reaktiv. Zudem können Dendriten den Separator perforieren, zur positiven Elektrode durchwachsen und somit die Zelle kurzschließen.
Daher werden die (relativ kleinen) Lithium-Atome in einem anderen Stoff eingelagert, meist Graphit, wo sie sich zwischen den Graphitebenen (nC) einlagern. Man spricht von einer Interkalationsverbindung (LixnC). Wesentlich für das Funktionieren der Interkalation ist die Ausbildung einer schützenden Deckschicht auf der negativen Elektrode, die für die kleinen Li+-Ionen durchlässig, für Lösungsmittelmoleküle jedoch undurchlässig ist. Ist die Deckschicht ungenügend ausgebildet, kommt es zur Interkalation von Li+-Ionen mitsamt den Lösungsmittelmolekülen, wodurch die Graphitelektrode irreversibel zerstört wird.
Aufbau
Das aktive Material der negativen Elektrode eines gängigen (2010) Li-Ionen-Akkus besteht aus Graphit. Die positive Elektrode enthält meist Lithium-Metalloxide (vom Spinell-Typ), wie LiCoO2 (Lithiumcobaltdioxid), LiNiO2 oder LiMn2O4.
Das Innere eines Lithium-Ionen-Akkumulators ist völlig wasserfrei (Gehalt an H2O < 20 ppm), an etwaigen Beschädigungen eindringendes Wasser reagiert unter starker Wärmeentwicklung mit Brand- und Verpuffungsgefahr. Der Elektrolyt besteht aus in aprotischen Lösungsmitteln wie Ethylencarbonat, Propylencarbonat, Dimethylcarbonat, Diethylcarbonat oder 1,2-Dimethoxyethan gelösten Lithiumsalzen wie LiPF6.
An Materialien kommen unter anderem folgende zum Einsatz:
- Negative Elektrode
- Graphit (Interkalation von Lithium)
- Nanokristallines, amorphes Silizium (Interkalation von Lithium)
- Li4Ti5O12 (Lithium-Titanat-Akku)
- SnO2 Zinndioxid
- Elektrolyt
- Salze, wie LiPF6 (Lithiumhexafluorophosphat) oder LiBF4 (selten) in wasserfreien aprotischen Lösungsmitteln (z. B. Ethylencarbonat, Diethylcarbonat etc.)
- Polymer aus Polyvinylidenfluorid (PVDF) oder Polyvinylidenfluorid-Hexafluorpropen (PVDF-HFP)
- Li3PO4N Lithiumphosphatnitrid
- Positive Elektrode
- LiCoO2
- LiNiO2
- LiNi1−xCoxO2
- LiNi0,85Co0,1Al0,05O2
- LiNi0,33Co0,33Mn0,33O2
- LiMn2O4 Spinell
- LiFePO4 (siehe Lithium-Eisen-Phosphat-Akkumulator)
Reaktionsgleichungen
Negative Elektrode (Entladung):
Positive Elektrode (Entladung):
Redox-Gleichung:
Metallisches Lithium kommt in keiner Reaktion vor, jedoch sind es, mit Ausnahme des Lithium-Titanat-Akkus, Lithium-Atome, nicht -Ionen, die an der negativen Elektrode in das Elektrodenmaterial interkaliert werden.
Eigenschaften
Wegen der Vielzahl an möglichen Materialien für Anode, Kathode und Separator ist es schwierig, allgemeingültige Aussagen für Lithiumionakkus zu treffen. Hinzu kommt die fortwährende Verbesserung durch die Batteriehersteller, die in den letzten Jahren insbesondere auf den bekannten Problemfeldern wie Haltbarkeit und Sicherheit erhebliche Verbesserungen erzielen konnten, während die Energiedichte nur im vergleichsweise geringen Umfang erhöht wurde.
- Kein Memory-Effekt[2]
- Selbstentladung
- sehr gering
- Lebensdauer
- Generell ist die Lebensdauer stark abhängig von den verwendeten Materialien und deren Qualität, insbesondere deren Reinheit, sowie vom Umgang mit dem Akku. Sehr hochwertige Zellen verlieren auch nach mehreren Jahren im Einsatz und zigtausenden Lade- und Entladezyklen nur einen sehr geringen Teil ihrer Kapazität und Leistung und verhalten sich entsprechend „fast wie neu“.[5]
- Die Mehrheit der in Endverbrauchergeräten verbauten Lithium-Ionen-Akkus der ersten Generationen hatte aber nur eine kurze Lebensdauer. Teilweise konnte der Nutzer schon nach einem Jahr erheblichen Kapazitätsverlust feststellen; nach zwei bis drei Jahren war so mancher Lithium-Ionen-Akku bereits unbrauchbar geworden. Dabei stellte sich heraus, dass der schleichende Kapazitätsverlust weniger von der Zahl der Lade- und Entladezyklen, sondern vor allem von den Lagerbedingungen abhing: Je höher die Temperatur und je voller der Akku, desto eher kam es zum Ausfall. Als Grund hierfür werden in der Regel parasitäre unumkehrbare chemische Reaktionen genannt.[6]
- Zunehmend werden jedoch auch im Endverbraucherbereich bessere Li-Ion-Akkus mit längerer Haltbarkeit verkauft. Apple gibt für die in die MacBooks eingebauten Akkus beispielsweise an, dass nach fünf Jahren und 1000 Zyklen immer noch 80 % der Anfangskapazität zur Verfügung stehen.[7] Bei Beachtung der von den schlechten Akkus der ersten Generationen gelernten Anwendungsregeln (Betrieb und Lagerung bei möglichst tiefer Temperatur; Lagerung nur im teilgeladenen Zustand; generell weder ganz vollladen noch ganz entladen) dürfte die mit den genannten moderneren Akkus tatsächlich erzielbare Zyklenzahl noch deutlich höher ausfallen.
- Coulomb-Effizienz
- typischerweise annähernd 100 %,[5] das heißt, fast der gesamte in den Akku geladene Strom kann diesem auch wieder entnommen werden. Nur während der ersten Zyklen ist die Coulomb-Effizienz geringer, da ein Teil der Li-Ionen mit der Elektrolytlösung an der Anode und Kathode irreversibel unter Ausbildung von Deckschichten reagiert.
- Energie-Effizienz
- Auch wenn es keine nennenswerten Stromverluste gibt, so gibt es doch Spannungsverluste, da sich der Innenwiderstand sowohl beim Laden als auch beim Entladen jeweils dem Stromfluss entgegenstellt. Typische Gesamtwirkungsgrade betragen somit um die 90 %.[5] Werden im Verhältnis zur maximalen Strombelastbarkeit des Akkus besonders kleine Lade- und Entladeströme verwendet, können auch weit über 90 % erreicht werden.
Material Spannung LiCoO2 3,6 V LiMnO2 3,7–3,8 V LiFePO4 3,3 V Li2FePO4F 3,6 V - Spannung
- Ein konventioneller Lithium-Ionen-Akku liefert eine Nennspannung von 3,6 Volt, die damit rund dreimal so hoch wie die eines Nickel-Metallhydrid-Akkumulators (NiMH-Akku) ist. Die Ladeschlusspannung liegt bei bis zu 4,2 Volt. Die Entladeschlusspannung beträgt 2,5 Volt; eine Tiefentladung führt zu irreversibler Schädigung und Kapazitätsverlust. Die Zellenspannung hängt jedoch vom verwendeten Kathodenmaterial ab und ist daher von Akkutyp zu Akkutyp leicht unterschiedlich.[8]
Material Gravimetrische
KapazitätLiCoO2 110–190 mAh/g LiMnO2 110–120 mAh/g Li2FePO4F 95–140 mAh/g - Leistungsdichte
- Die Leistungsdichte liegt typischerweise bei 300–1500 W/kg.[9]
- Energiedichte
- Die Energiedichte ist mehr als doppelt so hoch wie beispielsweise die des Nickel-Cadmium-Akkumulators und liegt bei 95–190 Wh/kg, beziehungsweise 250–500 Wh/l, je nach verwendeten Materialien. Anwendungen, die eine besonders lange Lebensdauer benötigen, beispielsweise der Einsatz in Elektroautos, laden und entladen den Lithium-Ionen-Akku oft nur teilweise (z. B. von 30 bis 80 % statt von 0 bis 100 %), was die Zahl der möglichen Lade- und Entladezyklen überproportional erhöht, aber die nutzbare Energiedichte entsprechend absenkt.[8]
Hinweise zum Umgang mit Li-Ionen-Akkus
Viele der im Folgenden für den Umgang mit klassischen Li-Ionen-Akkus zu beachtenden Anwendungshinweise gelten für dessen aktuelle Weiterentwicklungen nur mehr eingeschränkt oder gar nicht.
- Ladung
- Die Ladespannung beträgt typischerweise 4,2 V. Da Li-Ion-Akkus keinen Memory-Effekt kennen und auch nicht formiert werden müssen, werden sie immer auf die gleiche Art geladen: Zuerst wird mit konstantem Strom geladen, der idealerweise zwischen 0,6 und 1 C liegen sollte. Die Abkürzung C steht hier für den auf die Kapazität bezogenen relativen Ladestrom (d.h. A/Ah)[10] und ist nicht mit der Einheit Coulomb (d.h. As) zu verwechseln; ein Ladestrom von 0,75 C bedeutet, dass ein Akku mit einer Kapazität von 1 Ah mit 0,75 A geladen wird. Erreicht der Akku eine Zellenspannung von 4,2 V, wird diese Spannung gehalten, bis der Ladestrom fast auf Null zurückgefallen ist. Die Ladung wird mit Erreichen von 3 Prozent des Anfangsstroms beendet oder wenn der Ladestrom nicht mehr weiter absinkt.[8] Die Ladeschlussspannung von produktabhängig 4,1 V bis 4,2 V muss mit weniger als 50 mV Toleranz eingehalten werden. Zwar gibt es Schnellladeelektroniken, die mit bis zu 2 C laden, jedoch wird die Verkürzung der Ladezeit durch Kapazitäts- und Lebensdauerverlust des Akkus erkauft. Liegt die Zellenspannung unterhalb der Tiefentladeschwelle, lädt die Ladeelektronik bis zum Erreichen der Mindestspannung zunächst nur mit geringer Stromstärke.[2] Neue Entwicklungen wie etwa die SCiB erlauben durch ihren geringen Innenwiderstand auch ohne Einbußen der Lebensdauer erheblich höhere Ladeströme von über 10 C.
- Entladung
- Die Spannung des Li-Ion-Akkus sinkt während der Entladung kaum ab; erst kurz vor der vollständigen Entladung geht die Zellenspannung stark zurück.[11] Entladeschlussspannung ist 2,5 V; diese darf nicht unterschritten werden. Bei Entladung mit 0,2 C (das entspricht einem Entladestrom in Höhe von einem Fünftel des Nominalwerts der Nennkapazität) können typabhängig etwa 500 (Lithium-Cobalt) bis 4000 (Lithium-Eisen-Phosphat-Akkumulator) Ladezyklen durchgeführt werden, bis die Kapazität des Akkus auf 80 % seiner Ursprungskapazität zurückgefallen ist. Bei Entladung mit höheren Stromstärken altert der Akku aufgrund der durch die höheren Ströme entstehenden thermischen Belastung erheblich schneller. Idealerweise sollte ein Li-Ion-Akku mit 0,2 C belastet werden, ein Akku mit einer Kapazität von 5 Ah also mit maximal 1 A.[12]
- Idealer Ladungszustand
- Es ist empfehlenswert, Li-Ionen-Akkus „flach“ zu zyklen, wodurch sich deren Lebensdauer verlängert. Das Entladen unter 51 Prozent sollte vermieden werden, da es bei „tiefen Zyklen“ zu größeren Kapazitätsverlusten aufgrund irreversibler Reaktionen in den Elektroden kommen kann. Der Akku altert schneller, je höher seine Zellenspannung ist, daher ist es zu vermeiden, einen Li-Ion-Akku ständig 100 Prozent geladen zu halten.
- Überladung
- Bei einem Überladungsversuch wird der Akku durch seine Überwachungselektronik von den äußeren Kontakten getrennt, bis die zu hohe Spannung nicht mehr anliegt. Danach kann er meist ohne Probleme wieder verwendet werden. Nicht alle auf dem Markt erhältlichen Akkus enthalten eine solche Überwachungselektronik! Bei Überladung eines Li-Ion-Akkus lagert sich metallisches Lithium an der Anode ab. Das Kathodenmaterial wird zum oxidierenden Element und verliert seine Stabilität. Dadurch heizt sich der Akku auf und kann sogar in Brand geraten.[8]
- Tiefentladung
- Bei einer Tiefentladung schaltet eine interne Sicherung den Akku, meist nur temporär, ab. Es liegt dann an den externen Kontakten des Akkupacks überhaupt keine Spannung mehr an, das heißt er kann nicht noch weiter entladen werden. Manche Ladegeräte weigern sich, einen derartig defekt anmutenden Akku wieder zu laden, da in diesem Fall an den externen Kontakten keine Spannung messbar ist. Der Akku wird jedoch von seiner Schutzelektronik wieder an die Kontakte geschaltet, sobald eine äußere Spannung anliegt. In solchen Fällen kann es helfen, ein anderes Ladegerät zu verwenden. Wenn eine Zelle auf unter 1,5 V entladen wurde, sollte sie nicht mehr verwendet werden, denn mit hoher Wahrscheinlichkeit haben sich Brücken ausgebildet, die zu einem Kurzschluss führen. Die Zelle wird instabil und erhitzt sich stark. Es besteht Brandgefahr.
- Ladegeräte
- Herkömmliche Li-Ionen-Akkus dürfen nur mit einer speziellen Ladeschaltung geladen werden. Die Elektronik steuert den ladungsabhängigen Ladestrom und überwacht insbesondere die exakt einzuhaltende Ladeschlussspannung. Auch bei vorhandener interner Schutzschaltung sollte nur mit passenden Geräten geladen werden. Schnell-Ladegeräte sollten immer unter Aufsicht und möglichst nicht in der Nähe brennbarer Materialien benutzt werden.
- Integrierte Elektronik
- Li-Ion-Akkus reagieren sehr empfindlich auf falsche Behandlung, weshalb dieser Akkutyp zuerst nicht eingesetzt wurde, obwohl er bereits seit den 1980er-Jahren bekannt war.[13] Integrierte Schaltkreise sind sehr preisgünstig geworden; daher können Li-Ion-Akkus heute in Verbindung mit einer Elektronik (BMS = Battery Management and Monitoring System) betrieben werden, was die Sicherheit im Umgang mit diesem Akkutyp erheblich erhöht hat. Bei Akku-Packs kleiner und mittlerer Baugröße ist diese Elektronik meist integriert; sie dient zum Schutz gegen Tiefentladung, Überladung und thermische Überlastung. Eine selbstrückstellende Sicherung verhindert Überstrom beziehungsweise Kurzschluss. Die verwendete Prozessorsteuerung ist auf die Eigenschaften des jeweiligen Akkutyps abgestimmt. Akku-Packs, in denen zur Spannungserhöhung mehrere Zellen in Reihe geschaltet werden, verfügen oft auch über eine Elektronik, die durch sog. „Cell-Balancing“-Ladung und Entladung für jede einzelne Zelle individuell regelt.[14][15]
- Betriebs- und Umgebungstemperatur
- Da bei Kälte die chemischen Prozesse (auch die Zersetzung des Akkus bei der Alterung) langsamer ablaufen und die Viskosität der in Li-Zellen verwendeten Elektrolyte stark zunimmt, erhöht sich auch beim Lithium-Ionen-Akku bei Kälte der Innenwiderstand, womit die abgebbare Leistung sinkt. Zudem können die verwendeten Elektrolyte bei Temperaturen um −25 °C einfrieren. Manche Hersteller geben den Arbeitsbereich mit 0–40 °C an. Optimal sind 18–25 °C. Unter 10 °C kann durch den erhöhten Innenwiderstand die Leistung so stark nachlassen, dass sie nicht lange für den Betrieb eines Camcorders oder einer Digitalkamera ausreicht. Es gibt aber Li-Ionen-Akkus mit speziellen Elektrolyten, die bis −54 °C eingesetzt werden können.
- Lagerung
- Der Ladezustand soll 55–75 % betragen, kühle Lagerung ist vorteilhaft. Die Elektrolyte in der Zelle dürfen nicht gefrieren, was einer Mindesttemperatur um −25 °C entspricht. Hersteller empfehlen eine Lagerung bei 15 °C bei einem Ladestand von 60 % – ein Kompromiss zwischen beschleunigter Alterung und Selbstentladung. Ein Akku sollte etwa alle sechs Monate auf 55–75 % nachgeladen werden. Lithium-Ionen-Akkumulatoren dürfen sich auch bei Lagerung nicht unter 2,5 V pro Zelle entladen.
Gefahren beim Umgang mit Li-Ionen-Akkus
Viele der im Folgenden aufgeführten Risiken, die beim Umgang mit klassischen Li-Ionen-Akkus zu beachten sind, konnten bei den neuesten Weiterentwicklungen durch die Verwendung keramischer Separatoren eliminiert werden. Ohne diese Schutzmassnahmen neigen Li-Ionen zu thermischem Durchgehen, wie beispielsweise bei:
- Mechanische Belastung
- Mechanische Beschädigungen können zu inneren Kurzschlüssen führen. Die hohe Stromstärke lässt das Gehäuse schmelzen und in Flammen aufgehen. Unter Umständen ist der Defekt nicht unmittelbar zu erkennen. Auch 30 Minuten nach der Beschädigung kann es noch zum Brand kommen.
- Chemische Reaktionen
- Lithium ist ein hochreaktives Metall. Auch wenn es wie bei Lithiumbatterien „nur“ als chemische Verbindung vorliegt, sind die Komponenten eines Li-Ionen-Akkus leicht brennbar. Ausgleichsreaktionen beim Überladen, zum Beispiel die Zersetzung von Wasser zu Knallgas wie bei anderen Akkus, sind nicht möglich. Li-Ionen-Akkus sind zwar hermetisch gekapselt, dennoch sollten sie nicht in Wasser getaucht werden; (defekte) Lithium-Zellen reagieren grundsätzlich heftig mit Wasser,[16] insbesondere in voll geladenem Zustand. Brennende Akkus dürfen daher nicht mit Wasser, sondern sollten zum Beispiel mit Sand gelöscht werden. In den meisten Fällen besteht im Falle eines Brandes lediglich die Möglichkeit, auftretende Folgebrände zu löschen und den Akku kontrolliert abbrennen zu lassen. Die Elektrolytlösung ist meist brennbar. Ausgelaufene Elektrolytlösung eines Li-Ionen-Akkus kann fern vom Akku mit Wasser abgewaschen werden.
- Thermische Belastung
- Kraftfahrzeuge mit Hybridantrieb werden bislang (bis auf den Mercedes-Benz S 400 Hybrid, dessen Li-Ionen-Akku jedoch gegen thermische Überlastung in den Klimaanlagenkreislauf eingebunden ist) mit Nickel-Metallhydrid-Akkumulatoren betrieben, weil Lithium-Ionen-Akkumulatoren für Autos im Extremfall nicht sicher genug sind. Bei thermischer Belastung kann es in den Lithium-Ionen-Akkus zum Schmelzen des Separators und damit zu einem Kurzschluss mit verheerenden Folgen kommen. Neuartige keramische, temperaturbeständigere Separatoren gewähren allerdings eine erhöhte Sicherheit.
- Brand
- Interne Schutzschaltungen wie Temperatursensoren oder eine Spannungsüberwachung sollen bei Überladung oder Überlastung eine Entzündung der brennbaren Elektrolytlösung verhindern. Falls allerdings keine Schutzelektronik vorhanden oder selbige defekt ist, kann der Akku Feuer fangen. Li-Ionen-Akkus dürfen, wie andere Akkumulatoren auch, nicht kurzgeschlossen werden. Durch Kurzschluss (auch mit Metallschmuck oder Werkzeugen) können Feuer oder Verbrennungen verursacht werden. Moderne Li-Ionen-Phosphat-Zellen sind durch Keramikfolien besser gegen Überladen und mechanische Beschädigung abgesichert.
Anwendungsbereiche
Bereits in den 1970er Jahren wurden an der TU München das grundlegende Funktionsprinzip der reversiblen Alkalimetall-Ionen-Interkalation in Kohlenstoff-Anoden [17][18] und oxidische Kathoden [19][20] sowie dessen Anwendung in Lithium-Batterien [21][22] erforscht und veröffentlicht, auch wenn hier das Funktionsprinzip der Verwendung von Halbleitern, insbesondere Siliziummaterialien, als Elektroden nicht erkannt wurde.
Im November 1989 wurde in Deutschland ein Patent[23] für einen Lithium-Ionen-Akkumulator angemeldet sowie im folgenden ein Versuchsmuster angefertigt und erfolgreich getestet. Die deutsche Industrie zeigte damals allerdings kein Interesse an der Weiterentwicklung. Der erste kommerziell erhältliche Li-Ionen-Akku wurde von Sony im Jahr 1991 auf den Markt gebracht und in der Hi8-8-mm-Videokamera CCD TR 1 eingesetzt.
Li-Ionen-Akkus versorgen tragbare Geräte mit hohem Energiebedarf, für die herkömmliche Nickel-Cadmium- beziehungsweise Nickel-Metallhydrid-Akkus zu schwer oder zu groß wären, beispielsweise Mobiltelefone, Digitalkameras, Camcorder, Notebooks, Handheld-Konsolen oder Taschenlampen. Sie dienen bei der Elektromobilität als Energiespeicher für Pedelecs, Elektro- und Hybridfahrzeuge. Auch im RC-Modellbausektor haben sie sich etabliert. Neuerdings werden Lithium-Ionen-Akkus bei Elektrowerkzeugen wie zum Beispiel Akkuschraubern und bei Gartengeräten verwendet.
Ressourcenverbrauch
Je nach Art des Lithium-Akkus werden für eine Kilowattstunde Speicherkapazität etwa 80 Gramm (Lithium-Eisen-Phosphat-Akkumulator) bis 130 Gramm (Lithium-Mangan- und Lithium-Cobalt-Akkumulator) reines Lithium benötigt.
Der Massenanteil von Lithium in der Erdkruste ist etwa dreimal höher als der von Blei. Lithium ist allerdings gleichmäßiger verteilt, es sind nur wenige Lagerstätten mit hohen Lithiumanteilen bekannt. Wegen der Nachfragesteigerung und der damit verbundenen Preissteigerung geht man seit einigen Jahren dazu über, auch Salzseen mit einem geringen Lithiumgehalt (häufig weniger als 0,15 Prozent) für die Lithiumgewinnung zu nutzen. Prominentestes Beispiel ist hierfür die Salar de Uyuni in Bolivien. Lithium, beziehungsweise das häufigste Vorprodukt Lithiumcarbonat, wurde früher meist als Nebenprodukt bei der Gewinnung von Borax und Pottasche gewonnen. Heute wird es meist als Hauptprodukt und nur noch bei der Tantalförderung als Nebenprodukt gewonnen. Der Marktpreis[24] für Lithiumcarbonat liegt derzeit bei etwa 4,50 US-Dollar pro Kilogramm (Stand: 2008).
Die bei diesen Marktpreisen wirtschaftlich förderbaren Lithiumressourcen sind bei weitem nicht in der Lage, beispielsweise die weltweite Umstellung der Kraftfahrzeuge auf Elektroantrieb mit Lithium-Akkus zu decken. Dies hat vereinzelt zu Befürchtungen geführt, dass die sich anbahnende Elektrifizierung des Straßenverkehrs aufgrund begrenzter Ressourcen an Lithium nicht durchführbar sei. Diese Bedenken konnten aber leicht zerstreut werden, denn die Kosten für die Lithiummineralien spielen für die Kosten der Lithium-Akkus nur eine sehr untergeordnete Rolle. Für die Produktion von Lithium-Akkus wird metallisches Lithium benötigt, dessen Preis je nach Marktlage sehr stark schwankt (ca. 60 USD/kg im Jahr 1998 und ca. 550 USD/kg im Jahr 2008). Metallisches Lithium wird in einem relativ energieaufwendigen Prozess aus Lithiumcarbonat oder anderen Lithiumverbindungen gewonnen, vergleichbar mit der Gewinnung von reinem Silizium aus Sand. Neben der nicht mit der rasant wachsenden Nachfrage nach metallischem Lithium mithaltenden Produktionskapazität ist vor allem dieser aufwändige Produktionsprozess für die hohen Kosten des Lithiums verantwortlich. Die Kosten der Exploration und des Abbaus der Lithiummineralien spielen im Vergleich zu diesem Kostenfaktor praktisch keine Rolle.
In einer Studie[25] aus dem Jahr 1975 werden die Kosten für die Extrahierung von Lithium aus Seewasser auf 22 bis 32 US-Dollar pro Kilogramm geschätzt. Selbst wenn man diese Kosten für heute um den Faktor 10 multiplizieren müsste, wird der Preis für metallisches Lithium dadurch sehr viel weniger beeinflusst als durch die wechselnde Nachfrage. Die Menge des in den Ozeanen gelösten Lithiums übersteigt den Bedarf, der durch die vollständige Elektrifizierung des weltweiten Verkehrs entstünde, um viele Größenordnungen. Selbst für die Pufferung von Wind- und Solarstrom aller Stromnetze weltweit sind die Lithiumvorräte weit mehr als ausreichend.
Bei einer erfolgreichen Einführung der Kernfusion zur Stromerzeugung würde eine Verwendungskonkurrenz auftreten, da Lithium die nach derzeitigem Stand beste Quelle für die Herstellung des benötigten Tritiums wäre (siehe Fusionsreaktor).
Aktuelle Entwicklungen
Im April 2006 schrieb eine Gruppe von Wissenschaftlern des Massachusetts Institute of Technology, einen Prozess entwickelt zu haben, der für die Herstellung von Nanometer-großen Drähten Viren verwendet. Damit können ultradünne Lithium-Ionen-Akkus mit der dreifachen der bisher möglichen Energiedichte hergestellt werden.[26]
Im Juni 2006 stellten Forscher aus Frankreich Akku-Elektroden in Nanometer-Größe her, die ein Mehrfaches der Energiedichte im Vergleich zu gewöhnlichen Elektroden besaßen.[27]
Im September 2006 berichteten Forscher der Universität Waterloo in Kanada in der Zeitschrift Nature von einem neuen Kathodenmaterial, bei dem die Hydroxid-Gruppe der Eisenphosphat-Kathode durch Fluorid ersetzt wurde. Dies hat einen doppelten Vorteil: Erstens ergibt sich während eines Ladungszyklus eine geringere Volumenänderung in der Kathode, was eine längere Lebensdauer erwarten lässt. Zweitens erlaubt es den Ersatz des Lithiums durch Natrium beziehungsweise eine Natrium-Lithium-Mischung, weswegen er auch als Alkali-Ionen-Akku bezeichnet wird.[28]
Im Dezember 2007 berichteten Forscher der Stanford University von einem neuen Anodenmaterial für Lithium-Ionen-Akkus mit dem zehnfachen der bisher erreichten Energiedichte. Sie verwendeten dazu Silizium-Nanodrähte auf rostfreiem Stahl.[29] Es wird die Tatsache genutzt, dass Silizium als Trägermaterial größere Mengen Lithium einlagern kann als Graphit; die geringe Größe der Drähte löst das Problem des Aufbrechens der Anode. Allerdings ist die Anode nur ein Teil des Akkus; bei unveränderter Kathode, Separator und Elektrolyt ist entsprechend nur eine deutlich geringere Gesamtsteigerung der Energiedichte zu erwarten. Der Leiter des Forschungsteams, Yi Cui, erwartet, dass diese Technologie in etwa fünf Jahren kommerziell erhältlich sein wird.[30] Einen ähnlichen Ansatz mit nanoporösem Silicium[31] verfolgt das Team von Jaephil Cho von der Hanyang University in Ansan, Südkorea.
Am 12. März 2009 wurde eine Weiterentwicklung der Lithium-Ionen-Akkus durch die beiden MIT-Forscher Byoungwoo Kang und Gerbrand Ceder veröffentlicht, die sowohl die Lade- als auch die Entladegeschwindigkeit drastisch (10 Sekunden statt 6 Minuten für einen kleinen Test-Akku) erhöht.[32] Die Entwickler erwarten, dass diese Akkus in relativ kurzer Zeit kommerziell verfügbar sein werden, da keine neuen Materialien für die neue Technologie gebraucht werden.
Etwa im Juni 2011 berichteten Forscher der japanischen Firma Sumitomo Electric Industries, dass für den Fall, dass der Ableiter der Kathode, welcher üblicherweise aus Aluminiumfolie besteht, durch den Werkstoff Aluminium-Celmet ersetzt werden würde, dies eine Erhöhung der Akkumulator-Energiedichte um einen Faktor von 1,5 bis 3 ermöglicht. [33]
Lithiumtitanat-Akkumulator
Der Lithiumtitanat-Akkumulator ist eine Weiterentwicklung des Lithium-Ionen-Akkumulators, bei der die herkömmliche Graphitanode durch eine nanostrukturierte Lithiumtitanat-Anode ersetzt wird. Die wesentlich stärkere chemische Bindung des Lithiums im Titanat verhindert die Bildung einer Oberflächenschicht auf der Elektrode, die eine der Hauptgründe für die schnelle Alterung vieler herkömmlicher Li-Ion-Akkus ist. Dadurch wird die Zahl der möglichen Zyklen drastisch erhöht. Dadurch, dass das Titanat nicht mehr mit Oxiden aus der Kathode reagieren kann, wird auch das thermische Durchgehen des Akkus verhindert, selbst bei mechanischen Schäden. Außerdem kann der Akku aufgrund der Lithiumtitanat-Anode im Gegensatz zu herkömmlichen Lithium-Ionen-Akkus auch bei tiefen Temperaturen in einem Temperaturbereich von -40 °C bis +55 °C betrieben werden.
Die Lithiumtitanat-Anode besitzt darüber hinaus eine effektiv wirksame Oberfläche von 100 m2 pro Gramm im Vergleich zu 3 m2 pro Gramm einer Graphitelektrode.[34] Dadurch werden sehr kurze Ladezeiten und eine sehr hohe Leistungsdichte von etwa 4 kW/kg erreicht. Die Energiedichte liegt mit 70–90 Wh/kg hingegen vergleichsweise niedrig.
Lithium-Polymer-Akkumulator
Wie beim Lithium-Ionen-Akku besteht die negative Elektrode aus Graphit, die Positive aus Lithium-Metalloxid. Jedoch enthalten Lithium-Polymer-Akkus keinen flüssigen Elektrolyten, sondern einen auf Polymerbasis, der als feste bis gelartige Folie vorliegt. Die Bauform der Lithium-Polymer-Akkus unterliegt praktisch keinen Beschränkungen.
Lithium-Eisen-Phosphat-Akkumulator
Der Lithium-Eisen-Phosphat-Akkumulator (LiFePO4-Akkumulator) ist eine Weiterentwicklung des Lithium-Ionen-Akkumulators, bei dem die herkömmliche Lithium-Cobaltoxid-Kathode durch eine Lithium-Eisenphosphat-Kathode ersetzt wurde. Dieser Akku zeichnet sich durch hohe Lade- und Entladeströme, eine sehr gute Temperaturstabilität und eine lange Lebensdauer aus. Die Nominalspannung beträgt 3,2 V beziehungsweise 3,3 V, die Energiedichte beträgt 100–120 Wh/kg, die Leistungsdichte etwa 1,8 kW/kg.
Lithium-Luft-Akkumulator
Der Lithium-Luft-Akkumulator[35] ist eine neue Entwicklung durch das IBM Almaden Research Center, in der die Kathode durch Luft ersetzt wird. Als Anode dient metallisches Lithium, das vollständig an der Reaktion teilhaben kann. Da der für die Reaktion benötigte Sauerstoff aus der Umgebungsluft entnommen werden kann, wird die Kapazität einer Lithium-Luft-Zelle alleine durch die Größe der Lithium-Anode bestimmt. Die theoretisch erreichbare Energiedichte liegt, wenn man die Masse des Sauerstoffs nicht berücksichtigt, bei rund 11.000 Wh/kg bei einer Nominalspannung von 2,96 V. IBM geht von einer kommerziell erreichbaren Energiedichte von etwa 1000 Wh/kg aus, nahezu dem zehnfachen der Energiedichte der heute käuflichen Lithium-Ionen-Akkumulatoren. In einer für den maritimen Einsatz gedachten Variante des Lithium-Luft-Akkumulators wird der Sauerstoff aus Meerwasser bereitgestellt.
Bei diesem Akku besteht die Zelle aus vier Lagen, die jeweils eine positive und eine negative Elektrode sowie einen festen Elektrolyten beinhalten. Jede Lage hat 3,6 Volt und ist extra beschichtet, zusammen ergibt sich eine Zellspannung von 14,4 Volt. Die Zellen sind in einem flachen Gehäuse platziert, welches nur eine Größe von 10 x 10 Zentimeter hat. Die Elektroden und Elektrolyte bestehen aus Lithium-Cobalt-Dioxid sowie Graphit und Sulfiden. Ein Vorteil der Lithium-Feststoff-Technologie gegenüber herkömmlichen Lithium-Ionen-Speichern ist ihre Eigenschaft, schnell Energie aufnehmen und hohe Leistungen verarbeiten zu können. Daraus resultiert im Vergleich zu bisherigen Lösungen letztlich eine höhere Ausgangsleistung.
Im Vergleich zu den Lithium-Ionen-Akkus sind die Lithium-Feststoff-Akkus gekennzeichnet durch ihre Hitzebeständigkeit, so können die Feststoff-Akkus selbst bei Temperaturen um 100 Grad Celsius arbeiten, während Lithium-Ionen-Speicher anfangen zu brennen oder die flüssigen Bestandteile zu kochen beginnen. Ein weiterer Vorteil des Lithium-Feststoff-Akkus ist, dass er keine aufwändige Kühlung erfordert. Daher benötigt man weniger Platz bei gleicher Leistung oder verfügt über mehr Leistung bei gleichem Platzbedarf.
Einzelnachweise
- ↑ Der Duden in 12 Bänden. Duden 06: Max Mangold, Das Aussprachewörterbuch, 6. Auflage, 2005, ISBN 3-411-04066-1, S. 514
- ↑ a b c Lithium-Ionen-Akku. In: ITWissen.
- ↑ Justin Thomas (Bloggername: cephoe): New lithium-ion battery recharges to 90 % capacity in 5 minutes. In: MetaEfficient Reviews. 24. November 2008.
- ↑ Markus Pflegerl: Zinn-Schwefel-Li-Ionen-Akku: Stärker, langlebiger und sicherer. In: wattgehtab.com. 15. März 2010.
- ↑ a b c Life-Cycle Testing of Mars Surveyor Program Lander Lithium-Ion Battery Achieved Over 10,000 Low-Earth-Orbit Cycles. In: NASA.gov. 16. Oktober 2006.
- ↑ Isidor Buchmann: "Will Lithium-Ion batteries power the new millennium?" September 2008.
- ↑ Neue Macbook-Pro-Modelle mit 13 und 15 Zoll. In: golem.de. 8. Juni 2009.
- ↑ a b c d Charging lithium-ion batteries. In: BatteryUniversity.com. März 2006.
- ↑ E-One Moli Energy: Ankündigung einer neuen Zelle (Archivversion vom 11. März 2007)
- ↑ TecChannel.de: Akkus: Kurzlebig ab Werk – Seite 4 von 15
- ↑ Lithium-Ionen-Akku. In: qsl.net.
- ↑ Bernhard Haluschak: Akkus: Kurzlebig ab Werk. In: Tecchannel. 23. September 2005.
- ↑ Isidor Buchmann: Wann wurde die Batterie erfunden? In: Batterien-Montage-Zentrum GmbH.
- ↑ Battery Management Systems (BMS). In: Electropaedia.
- ↑ Multi-Cell Li-ion Battery Pack OCP/Analog Front End bei intersil
- ↑ YouTube: Lithium and Water
- ↑ J. O. Besenhard and H. P. Fritz, Cathodic Reduction of Graphite in Organic Solutions of Alkali and NR 4+ Salts, J. Electroanal. Chem., 53, 329 (1974).
- ↑ J. O. Besenhard, The Electrochemical Preparation and Properties of Ionic Alkali Metal and NR 4+ Graphite Intercalation Compounds in Organic Electrolytes, Carbon, 14, 111 (1976).
- ↑ R. Schallhorn, R. Kuhlmann, and J. O. Besenhard, Topotactic Redox Reactions and Ion Exchange of Layered MoO3 Bronzes,, Mat. Res. Bull., 11, 83 (1976).
- ↑ J. O. Besenhard and R. Schallhorn, The Discharge Reaction Mechanism of the MoO3 Electrode in Organic Electrolytes” J. Power Sources, 1, 267 (1976/77).
- ↑ J. O. Besenhard and G. Eichinger, High Energy Density Lithium Cells. Part I. Electrolytes and Anodes, J. Electroanal. Chem., 68, 1 (1976); and G. Eichinger.
- ↑ J.O. Besenhard, High Energy Density Lithium Cells. Part II. Cathodes and Complete Cells, J. Electroanal. Chem., 72, 1 (1976).
- ↑ Patent DD290979: Galvanisches Element. Angemeldet am 10. November 1989, Erfinder: Peter Busch.
- ↑ Marktpreis für Lithiumcarbonat (PDF-Datei)
- ↑ Meyer Steinberg, Vi-Duong Dang: Preliminary Design and Analysis of a Process for the Extraction of Lithium from Seawater. 1975 (Lithiumextraktion aus Seewasser).
- ↑ Ki Tae Nam u. a.: Virus-Enabled Synthesis and Assembly of Nanowires for Lithium Ion Battery Electrodes. In: Science. 312, Nr. 5775, 2006, S. 885–888, doi:10.1126/science.1122716.
- ↑ Kevin Bullis: Higher-Capacity Lithium-Ion Batteries. In: Technology Review. 22. Juni 2006.
- ↑ B. L. Ellis u. a.: A multifunctional 3.5 V iron-based phosphate cathode for rechargeable batteries. In: Nature Materials. 6, Nr. 10, 2007, S. 749–753, doi:10.1038/nmat2007.
- ↑ New Nanowire Battery Holds 10 Times The Charge Of Existing Ones. In: ScienceDaily. 20. Dezember 2007 (Meldung auf Sciencedaily.com).
- ↑ Interview with Dr. Cui, Inventor of Silicon Nanowire Lithium-ion Battery Breakthrough. In: GM-Volt. 21. Dezember 2007 (Interview auf der Website gm-volt.com).
- ↑ Peter Fairley: Realizing Lithium-Battery Potential. In: Technology Review. 3. Dezember 2008.
- ↑ Rainer Kayser: Der Super-Akku. In: pro-physik.de. 12. März 2009.
- ↑ Gernot Goppelt: „Aluminium-Celmet“ soll die Kapazität von Lithium-Ionen-Batterien verdreifachen Heise-Internetportal, Rubrik „Auto“, Sektion „News“, 30. Juni 2011
- ↑ Duncan Graham-Rowe: Charge a battery in just six minutes. In: New Scientist. 7. März 2005.
- ↑ Lithium/Air Semi-fuel Cells: High Energy Density Batteries Based On Lithium Metal Electrodes. In: Almaden Institute 2009. Scalable Energy Storage: Beyond Lithium Ion. 26.–27. August 2009.
Literatur
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren. Mobile Energiequellen für heute und morgen. Springer, Berlin 1998, ISBN 3-540-62997-1.
- David Linden: Handbook of Batteries. 3. Auflage. Mcgraw-Hill, New York 2008, ISBN 978-0-0713-5978-8.
- J. O. Besenhard: Handbook of Battery Materials. Wiley-VCH, Weinheim 1999, ISBN 3-527-29469-4.
- Masaki Yoshido (Hrsg.): Lithium-Ion Batteries. Science and Technologies. Springer, New York 2009, ISBN 978-0-387-34444-7.
Weblinks
- Umfangreiche Informationen über Lithium-Ionen-Akkus in Notebooks
- Skript über diverse Typen von Lithium-Batterien (PDF-Datei; 3,20 MB)
- Berechnung von Verbrauch und Ladezeit
- Lithium-Akkus für Elektroautos – Erfahrungsbericht
- Simulation von Lithium-Ionen-Akkus bei der Entwicklung von Elektro- und Hybridfahrzeugen
- Varta Automotive (Hrsg.): Die Entwicklung der Batterie. Kapitel 7: Lithium-Ionen-Batteriesystem. Abgerufen am 4. Jan. 2009.
- Thomas Kretschmann: Kapazität von Li-Ionen-Akkus verzehnfacht. In: Tom’s Hardware DE. 21. December 2007
- Matthias Gräbner: Drahtiges Silizium. In: Telepolis. 22. Dezember 2007
- List of manufacturer of batteries and ultracapacitors for plug-ins (EV,PHEV). In: AortaCity. 10. August 2008 (Liste von Herstellern von Lithium-Ionen-Batterien für Elektrofahrzeuge)
- ZSW Ulm
Primärzellen: Alkali-Mangan-Batterie | Lithiumbatterie | Lithium-Eisensulfid-Batterie | Lithium-Mangandioxid-Batterie | Lithium-Thionylchlorid-Batterie | Lithium-Schwefeldioxid-Batterie | Lithium-Kohlenstoffmonofluorid-Batterie | Nickel-Oxyhydroxid-Batterie | Quecksilberoxid-Zink-Batterie | Silberoxid-Zink-Batterie | Zink-Braunstein-Zelle | Zinkchlorid-Batterie | Zink-Luft-Batterie
Sekundärzellen: Bleiakkumulator | Natrium-Schwefel-Akkumulator | Nickel-Cadmium-Akkumulator | Nickel-Eisen-Akkumulator | Nickel-Lithium-Akkumulator | Nickel-Metallhydrid-Akkumulator | Nickel-Wasserstoff-Akkumulator | Nickel-Zink-Akkumulator | Lithium-Eisen-Phosphat-Akkumulator | Lithium-Ionen-Akkumulator | Lithium-Mangan-Akkumulator | Lithium-Polymer-Akkumulator | Lithium-Schwefel-Akkumulator | Silber-Zink-Akkumulator | STAIR-Zelle | Vanadium-Redox-Akkumulator | Zink-Brom-Akkumulator | Zebra-Batterie | Zellulose-Polypyrrol-Zelle | Zinn-Schwefel-Lithium-Akkumulator
Historische Zellen: Daniell-Element | Gravity-Daniell-Element | Leclanché-Element | Voltasche Säule | Clark-Normalelement | Weston-Normalelement | Zambonisäule
Ausführungen: Akkumulator | Batterie | Brennstoffzelle | Knopfzelle | Konzentrationselement | Redox-Flow-Zelle | Thermalbatterie | Bestandteile: Halbzelle (Donator- und Akzeptorhalbzelle)
Wikimedia Foundation.