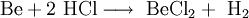- BeCl2
-
Strukturformel 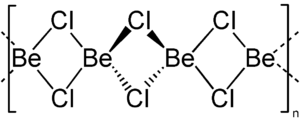
Allgemeines Name Berylliumchlorid Andere Namen Chlorberyllium
Summenformel BeCl2 CAS-Nummer 7787-47-5 Kurzbeschreibung süß schmeckende, farblose, zerfließende Kristalle[1] Eigenschaften Molare Masse 79,92 g·mol-1 Aggregatzustand fest
Dichte 1,9 g·cm-3[1]
Schmelzpunkt 405 °C[1]
Siedepunkt 482 °C[1]
Löslichkeit leicht löslich in Wasser, Alkohol und anderen organischen Lösungsmittel[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 49-25-26-36/37/38-43-48/23-51/53 S: 45-53-61 LD50 86-200 mg·kg-1[3]
WGK 3 – stark wassergefährdend Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Berylliumchlorid ist eine anorganische Verbindung aus dem zweiwertigen Leichtmetall Beryllium (Be) und dem einwertigen Halogen Chlor (Cl). Die Summenformel von Berylliumchlorid lautet BeCl2.
Gewinnung und Darstellung
BeCl2 kann durch Reaktion von Beryllium mit Salzsäure gewonnen werden
Physikalische Eigenschaften
Die Be-Cl-Bindung hat stark kovalente Anteile. Berylliumchlorid bildet daher auch kein Ionengitter wie etwa Magnesium- oder Calciumchlorid, sondern eine kettenförmige Struktur, in der jeder Berylliumkern tetraedrisch von vier Chloratomen umgeben ist.
In der Gasphase finden sich monomere und dimere BeCl2-Einheiten, in denen der intrinsische Elektronenmangel am Berylliumatom durch partiellen Doppelbindungscharakter der Be-Cl-Bindung verringert wird. Die Bindungslänge im Monomer beträgt 170 pm.[4]
Quellen
- ↑ a b c d e CD Römpp Chemie Lexikon - Version 1.0, Stuttgart/New York: Georg Thieme Verlag 1995
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Berylliumverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ Eintrag zu Berylliumchlorid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 24.9.2007 (JavaScript erforderlich)
- ↑ Holleman, Wiberg, Lehrbuch der Anorganischen Chemie, S. 1108f, 101. Auflage, 1995, deGruyter Verlag.
Wikimedia Foundation.