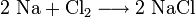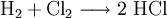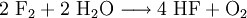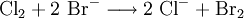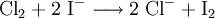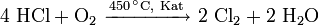- Halogen
-
Gruppe 17 Hauptgruppe 7 Periode 2 9
F3 17
Cl4 35
Br5 53
I6 Als Halogene [halogeːnə] („Salzbildner“, von agr. ἅλς halos, „Salz“ und γεννάω gennáō, „erzeugen“) werden die Elemente der 7. Hauptgruppe (17. Gruppe) des Periodensystems der chemischen Elemente bezeichnet. Diese Nichtmetalle sind im elementaren Zustand sehr reaktionsfreudig (Fluor kann Brände auslösen), farbig und reagieren mit Metallen zu Salzen (Namensherkunft) und mit Wasserstoff unter Normalbedingung zu Halogenwasserstoffen (gasförmige, einprotonige Säuren).
Zu den Halogenen gehören die Elemente Fluor, Chlor, Brom, Iod und das äußerst seltene radioaktive Element Astat. Die erstgenannten vier stabilen Elemente spielen wichtige Rollen in Chemie, Biologie und Medizin. Astat dient in organischen Verbindungen in der Nuklearmedizin zur Bestrahlung bösartiger Tumore[1]. Die Elemente der direkten Nachbargruppen werden einerseits als Chalkogene und andererseits als Edelgase bezeichnet.
Inhaltsverzeichnis
Eigenschaften
Physikalische Eigenschaften
Elementare Halogene sind farbige, leicht flüchtige bis gasförmige Substanzen, die in Wasser löslich sind (Fluor reagiert). Ihre Farbkraft, Siedetemperatur und Dichte nehmen mit der Ordnungszahl zu, die Giftigkeit (Toxizität) ab. Sie liegen in Form von zweiatomigen Molekülen der Form X2 vor (z. B. F2 und Cl2) und sind daher Nichtleiter (Isolatoren).
Chemische Eigenschaften
Halogene sind sehr reaktionsfreudige Nichtmetalle, da ihnen nur noch ein einziges Valenzelektron zur Vollbesetzung der Valenzschale fehlt. Da die Halogen-Halogen-Bindung nicht sehr stabil ist, reagieren auch Halogenmoleküle heftig; die Reaktivität nimmt, wie die Elektronegativität, von Fluor zu Iod ab. Gleichzeitig steigt die 1. Ionisierungsenergie nach oben hin an. Die Eigenschaften von Astat sind jedoch größtenteils unerforscht, wahrscheinlich ist es aber aus chemischer Sicht dem Iod sehr ähnlich.
- Halogene reagieren mit Metallen unter Bildung von Salzen, was ihnen ihren Namen einbrachte.
- Halogene reagieren exotherm mit Wasserstoff unter Bildung von Halogenwasserstoffen, die, in Wasser gelöst, mehr oder weniger starke Säuren sind. Die Heftigkeit der Reaktion nimmt von Fluor zu Iod ab.
- Beispiel: Chlorknallgasreaktion:
- Die Wasserlöslichkeit der Halogene nimmt von Fluor zu Iod ab, wobei Fluor mit Wasser unter Bildung von Fluorwasserstoff und Sauerstoff reagiert.
- Die Farbintensität im gasförmigen Aggregatzustand steigt mit zunehmender Ordnungszahl (siehe Bild oben).
- Dichte, Schmelz- und Siedepunkt nehmen aufgrund der Zunahme der Molmasse von oben nach unten zu. Bei Standardbedingungen sind Fluor und Chlor Gase, Brom ist eine Flüssigkeit und Iod fest.
- Die Halogene sind von Iod zu Fluor zunehmend giftig.
Verbindungen
Halogenide
- Hauptartikel: Halogenide
_iodide.jpg) Kupfer(I)-iodid, ein aus Kupfer(II)-sulfat-Lösung und Natriumiodid synthetisierbares Präparat (wasserunlöslich)
Kupfer(I)-iodid, ein aus Kupfer(II)-sulfat-Lösung und Natriumiodid synthetisierbares Präparat (wasserunlöslich)Ionische Halogenverbindungen wie z. B. die Fluoride, Chloride, Bromide und Iodide sind salzartige Stoffe. Dementsprechend haben sie hohe Schmelzpunkte, sind spröde und elektrische Nichtleiter außer in Schmelze und Lösung. Die meisten Halogenide sind wasserlöslich (wie z. B. Kochsalz, Natriumchlorid; wasserunlöslich sind Blei-, Quecksilber- und Silberhalogenide (vgl. Salzsäuregruppe) sowie Kupfer(I)-halogenide. Viele Halogenide kommen in der Natur in Form von Mineralien vor (s. u.).
Halogenwasserstoffe
- Hauptartikel: Halogenwasserstoffe
- HF, Fluorwasserstoff, ist in Wasser gelöst eine schwache Säure (Flusssäure). Aufgrund der starken Wasserstoffbrücken siedet Fluorwasserstoff trotz der geringen Molmasse erst bei 19,5 °C.
- HCl, Chlorwasserstoff, löst sich in Wasser unter Bildung einer starken Säure (Salzsäure). Siedepunkt: −85 °C
- HBr, Bromwasserstoff, ist in wässriger Lösung eine der stärksten Säuren (Bromwasserstoffsäure). Siedepunkt: −67 °C
- HI, Iodwasserstoff, bildet in Wasser die stärkste bekannte sauerstofffreie (nicht-komplexe) Säure (Iodwasserstoffsäure). Siedepunkt: −35 °C
Sauerstoffsäuren der Halogene
Mit Ausnahme von Fluor, dessen einzige Sauerstoffsäure die instabile Hypofluorige Säure ist, bilden die Halogene vier Arten von Sauerstoffsäuren, die wie folgt benannt werden:
- HXO: Hypohalogenige Säure (Beispiel: Hypochlorige Säure)
- HXO2: Halogenige Säure (Beispiel: Chlorige Säure)
- HXO3: Halogensäure (Beispiel: Chlorsäure)
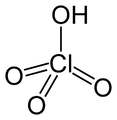
- HXO4: Perhalogensäure (Beispiel: Perchlorsäure)
Die Säurestärke wächst mit steigender Zahl der Sauerstoffatome, ebenso die oxidierende Wirkung. Die meisten Sauerstoffsäuren der Halogene sind sehr instabil und zersetzen sich exotherm.
Interhalogenverbindungen
- Hauptartikel: Interhalogenverbindungen
Interhalogenverbindungen sind Verbindungen der Halogene untereinander. Es gibt folgende Arten (Y ist das elektronegativere Element):
- XY : alle möglichen Kombinationen existent
- XY3: Y ist Fluor, Chlor oder Iod (in IBr3)
- XY5: Y ist immer Fluor
- XY7: nur IF7 bekannt
Interhalogenverbindungen sind bei Standardbedingungen instabil oder äußerst reaktiv.
Es existieren auch Interhalogenidionen wie beispielsweise BrF6− und IF6−. Auch Sauerstoffsäurehalogenide wie z. B. Perchlorylfluorid ClO3F oder Iodoxipentafluorid IOF5 sind bekannt.
Vorkommen
Halogene kommen in der Natur vor allem als einfach negativ geladene Anionen in Salzen vor. Das zugehörige Kation ist meist ein Alkali- oder Erdalkalimetall, insbesondere die Natriumsalze der Halogene sind häufig anzutreffen. Aus diesen können dann die Halogene mittels Elektrolyse gewonnen werden. Ein nicht unbeträchtlicher Teil der Halogenide ist im Meerwasser gelöst.
Wichtige Halogenid-Verbindungen:
- Natriumfluorid, NaF
- Calciumfluorid, CaF2 (Flussspat)
- Natriumchlorid, NaCl (Kochsalz)
- Kaliumchlorid, KCl
- Natriumbromid, NaBr
- Kaliumbromid, KBr
- Natriumiodid, NaI
Im Gegensatz zu den anderen Halogenen kommt Iod auch in der Natur als Iodat vor. Astat, das seltenste natürlich vorkommende Element, ist Zwischenprodukt der Uran- und Thoriumzerfallsreihe. Die Gesamtmenge in der Erdkruste beträgt lediglich 25 g.
Gewinnung der Reinelemente
Fluorgas F2 lässt sich nur durch elektrochemische Vorgänge gewinnen, da es kein Element und keine Verbindung gibt, die ein größeres Redox-Potential als Fluor hat und dieses oxidieren könnte (Oxidation, weil Elektronenabgabe von 2 F− zu F2, andere Halogene dito).
Alle anderen Halogene lassen sich neben dem Elektrochemischen Vorgang (z. B. Chloralkalielektrolyse) auch durch Oxidationsmittel wie MnO2 (Braunstein), KMnO4 (Kaliumpermanganat) gewinnen.
Eine weitere Möglichkeit zur Gewinnung von Brom oder Iod ist das Einleiten von Chlorgas als Oxidationsmittel in konzentrierte Bromid- bzw. Iodidlösungen:
Hier sei zur Gewinnung von Chlor auch das Deacon-Verfahren erwähnt (Redoxreaktion von Salzsäuregas mit Luft als Oxidationsmittel zu Wasser und Chlorgas):
Verwendung
In der organischen Chemie werden sie zur Synthese von Halogenverbindungen verwendet. Das Verfahren wird allgemein als Halogenierung bezeichnet.
Durch Zugabe von Halogenen in Glühlampen wird deren Lebensdauer und Lichtausbeute erhöht. Man spricht dann auch von Halogenlampen.
Nachweise
- ↑ Willhauck MJ, Samani BR, Wolf I, et al: The potential of 211Astatine for NIS-mediated radionuclide therapy in prostate cancer. In: Eur. J. Nucl. Med. Mol. Imaging. 35, Nr. 7, July 2008, S. 1272–81. doi:10.1007/s00259-008-0775-4. PMID 18404268
Weblinks
- Seite über Halogene in der Umwelt
- Kurzbeschreibung der Halogene
- Weitere Kurzbeschreibung der Halogene
- Reaktivität der Halogene anhand des Beispiels Na + Cl
Alkalimetalle | Erdalkalimetalle | Scandiumgruppe | Titangruppe | Vanadiumgruppe | Chromgruppe | Mangangruppe | Eisengruppe | Cobaltgruppe | Nickelgruppe | Kupfergruppe | Zinkgruppe | Borgruppe | Kohlenstoffgruppe | Stickstoffgruppe | Chalkogene | Halogene | Edelgase
Alkalimetalle | Erdalkalimetalle | Halogene | Edelgase Lanthanoide | Actinoide | Übergangsmetalle | Metalle | Halbmetalle | Nichtmetalle
Wikimedia Foundation.