- Wasserglas
-
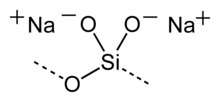
Als Wasserglas werden aus einer Schmelze erstarrte, glasartige, also amorphe, wasserlösliche Natrium- und Kaliumsilicate oder ihre wässrigen Lösungen bezeichnet. Je nachdem, ob überwiegend Natrium- oder Kaliumsilicate enthalten sind, spricht man von Natronwasserglas oder von Kaliwasserglas.
Inhaltsverzeichnis
Geschichte
Nachdem von Helmond schon 1640 die noch leichter lösliche Kieselfeuchte[1] entdeckte, wurde das Wasserglas 1818 durch Johann Nepomuk von Fuchs erstmals hergestellt;[2] von Fuchs gab der neuen Verbindung auch ihren Namen.[3]
Herstellung
Zur Herstellung von festen Wassergläsern (Festgläser) werden Gemenge aus Quarzsand und Kaliumcarbonat (für Kaliwasserglas) bzw. Natriumcarbonat (für Natronwasserglas) unter CO2-Entwicklung bei 1100 °C bis 1200 °C [4] verschmolzen:
Die von der Zusammensetzung der Gemenge abhängige, allgemeine Formel M2O · n SiO2 von technisch wichtigen Wassergläsern liegt etwa im Bereich zwischen n gleich 1 bis 4.[5] In der Regel werden für ein Wasserglas das Mol- oder Massenverhältnis von SiO2 zu Na2O bzw. SiO2 zu K2O angegeben. Natronwasserglas (siehe auch Natriumsilicate) mit dem Molverhältnis 3,4 bis 3,5 bildet den mengenmäßig wichtigsten Anteil.
Das abgekühlte Glas wird zu einem Pulver gemahlen. Daraus wird durch Lösen in Wasser bei hohen Temperaturen (z. B. 150 °C bei 5 bar Druck) flüssiges Wasserglas (Flüssigglas) als klare, kolloide alkalische Lösung oder auch als alkalisches Gel (gallertartige bis feste Masse) gewonnen.
Verwendung
Zur Anwendung kommt meist flüssiges Wasserglas (flüssiges Kalium-/Natriumsilicat, Liquid Glass, LIQVOR SILICIVM). In der Keramik dient es als Elektrolyt zur Verflüssigung einer keramischen Masse. Benutzt wird es zudem z. B. als Klebstoff (z. B. zum Aufkleben der Elfenbeinplatten auf Klaviertasten), als Bleichmittel in der Papierindustrie, als Bindemittel (z. B. bei Mineralfarben), als Zusatz in Schweißelektroden, in Waschmitteln, um Bauteile von Waschmaschinen vor Korrosion zu schützen, als Abdichtung bei Mauerwerk, Deponien und im Untertagebau, zum Schutz von Natursteinen vor Witterungseinflüssen, bei Sol-Gel-Prozessen und als Pflanzenstärkungsmittel in der ökologischen Landwirtschaft. In der Mikrobiologie wird Wasserglas als Ersatz für Agar, der im sauren pH-Bereich hydrolysiert, bei der Herstellung von festen Nährmedien für die Anzucht säureliebender (acidophiler) Bakterien eingesetzt. In der Gießereitechnik benutzt man Wasserglas zum Härten von Sandformen und Kernen.
Eine vor der Verbreitung von Kühlschränken gebräuchliche Konservierungsmethode, z. B. zum Einlegen von Eiern, beruht ebenfalls auf Wasserglas: Man rührt eine gewisse Menge der Alkalisilicatlösung in Wasser (meist 1 Teil Wasserglas auf 9 Teile Wasser) und schlägt die Mischung mit einem Schneebesen auf. Nach einer Weile wird die Lösung dann gallertartig/halbfest. In diese Lösung werden die gereinigten Eier eingelegt. Die Wirkung dieser Konservierungsmethode basiert darauf, dass die Poren der Eierschale aufgefüllt werden und die Schale dadurch vor dem Eindringen von Keimen und Wasser oder Luft geschützt ist.
Ende des zwanzigsten Jahrhunderts wurde Wasserglas (vor allem als Natriumsilicat) oft in „magischen Kristallgärten“ benutzt. Dazu wurde Wasserglas mit verschiedenen Metallsalzkristallen vermischt, wobei farbige, stängelartige Gebilde aus den Kristallen herauswuchsen. Chemisch gesehen ist dies eine Folge der Polymerisation der Natriumsilicationen unter Einfluss der als Lewissäuren dienenden Metallionen; die Farbe der Gebilde entsteht durch die Substitution der Natriumionen durch andere Metallionen. Die farbigen Fortsätze können sowohl stalaktit- als auch stalagmitähnlich sein, abhängig davon, ob die Kristalle nach unten sinken oder auf der Oberfläche schweben. Dazu ist zu bemerken, dass die Gebilde den angegebenen Tropfsteinformationen nur in der Form ähneln, und dass in diesem Fall die Verteilung (oben/unten) vertauscht ist. Das Streben dieser Strukturen, nach oben zu wachsen, entsteht dadurch, dass das Polymer wie eine semipermeable Membran agiert, welche die hochkonzentrierte Metallsalzlösung einschließt; das Wachstum entsteht dementsprechend durch ein kontinuierliches 'Platzen' dieser Membran an der Stelle, wo sie am dünnsten ist (oben).
In den USA wird die Chemikalie gegenwärtig benutzt, um zu verschrottende Motoren vor Inanspruchnahme einer staatlichen Verschrottungsprämie tatsächlich nachweislich unbrauchbar zu machen (Verschrottungspflicht). Dies geschieht, indem das Motoröl durch eine wässrige Natriumsilicatlösung ersetzt wird.[6] Im April 2011 wurde ein Abdichtmittel auf Wasserglas-Basis zum Verschließen eines Lecks am havarierten japanischen Kernkraftwerk Fukushima I verwendet, aus dem hoch kontaminiertes Wasser ins Meer austrat.[7][8]
Weblinks
- http://www.zeno.org/Meyers-1905/A/Wasserglas
- Sicherheitsdatenblatt (PDF) (35 kB)
- Inchem: lösliche Silicate (PDF, englisch) (1,08 MB)
- Bauschädigende Wirkung von Wasserglas an Wandmalereien und historischen Putzen
Einzelnachweise
- ↑ http://www.zeno.org/Meyers-1905/A/Kieselfeuchtigkeit
- ↑ http://www.baufachinformation.de/denkmalpflege.jsp?md=1997117109303
- ↑ Thieme Chemistry (Hrsg.): Eintrag zu Wasserglas im Römpp Online. Version 3.14. Georg Thieme Verlag, Stuttgart 2011, abgerufen am 9. April 2011.
- ↑ Soluble Silicate Manufacture (Englisch)
- ↑ A. F. Holleman, E. Wiberg: Lehrbuch der anorganischen Chemie, 91.–100. Auflage, de Gruyter, Berlin 1985, S. 779, ISBN 3-11-007511-3
- ↑ Tageszeitung: derstandard
- ↑ Wasserglas dichtet Leck in Fukushima ab. Meldung beim Deutschlandfunk vom 6. April 2011.
- ↑ Out flow of fluid containing radioactive materials to the ocean from areas near intake channel of Fukushima Daiichi Nuclear Power Station Unit 2 (continued report) (englisch, pdf). Tepco, 6. April 2011, archiviert vom Original, abgerufen am 17. Mai 2011.
Wikimedia Foundation.