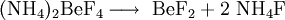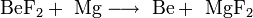- Berylliumdifluorid
-
Strukturformel 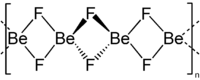
Allgemeines Name Berylliumfluorid Andere Namen - Beryllium(II)-fluorid
- Berylliumdifluorid
Summenformel BeF2 CAS-Nummer 7787-49-7 Kurzbeschreibung hygroskopische glasartige Masse Eigenschaften Molare Masse 47,01 g/mol Aggregatzustand fest
Dichte 1,986 g/cm3[1]
Schmelzpunkt 555 °C[1]
Löslichkeit sehr leicht löslich in Wasser, wenig löslich in Alkohol[2]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 49-25-26-36/37/38-43-48/23-51/53 S: 53-45-61 MAK aufgehoben, da cancerogen[1]
LD50 oral Ratte: 98 mg/kg [4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Beryllium(II)-fluorid ist eine chemische Verbindung aus Beryllium und Fluor mit der Formel BeF2.
Inhaltsverzeichnis
Physikalische Eigenschaften
Berylliumfluorid bildet im Festkörper polymere quarzähnliche Strukturen aus. Hierbei ist jeder Berylliumkern tetraedrisch von vier Fluorkernen umgeben. Dies ist ein Gegensatz zum isoelektronischen Kohlenstoffdioxid (CO2). In der polymeren Struktur verbrückt jeder Fluorkern zwei Berylliumkerne. Hierbei wird auch Schrägbeziehung des Berylliums zum Aluminium deutlich, das ähnliches Verhalten zeigt.
Gasförmiges Berylliumfluorid, das durch Erhitzen erhalten werden kann, sowie Berryliumfluorid, das sich in der Gasphase über dem Feststoff befindet, liegt als lineares Monomer vor. Es bildet eine schwache π-Bindung vom Fluor zum Berrylium aus, um dessen Elektronenmangel zu kompensieren. Der Be-F-Abstand beträgt hierbei 143 pm.[5]
Gewinnung und Darstellung
Gewonnen werden kann Berylliumfluorid durch Thermolyse von Ammonium-tetrafluoridoberyllat(II) (einer Berylliumkomplexverbindung die durch Reaktion von Berylliumoxid (BeO) mit Ammoniumfluorid (NH4F) erhalten werden kann)[6] [7] bei ~900 °C.
Verwendung
Sie dient als Ausgangsstoff zur Herstellung von reinem Beryllium, welches durch Reduktion mit Magnesium von Berylliumfluorid bei 1300 °C erhalten werden kann.
Berylliumfluorid wird zur Herstellung von Beryllium, von Gläsern und in der Reaktortechnik verwendet.
Sicherheitshinweise
Berylliumfluorid ist wie alle Berylliumverbindungen hochgiftig und wird als Krebserregend eingestuft[1].
Quellen
- ↑ a b c d Eintrag zu CAS-Nr. 7787-49-7 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 18.8.2007 (JavaScript erforderlich)
- ↑ http://ntp.niehs.nih.gov/ntp/roc/eleventh/profiles/s022bery.pdf
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Berylliumverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ http://c1155.camd.lsu.edu/MSDS/health.aspx
- ↑ Holleman, Wiberg, Lehrbuch der Anorganischen Chemie, S. 1108f, 101. Auflage, 1995, deGruyter Verlag.
- ↑ http://www.webelements.com/webelements/compounds/text/Be/Be1F2-7787497.html
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 231-2.
Wikimedia Foundation.