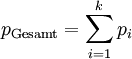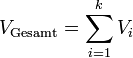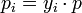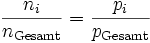- CO2-Partialdruck
-
Der Partialdruck ist der Druck, der in einem Gasgemisch wie z. B. der Luft, einem bestimmten Gas zugeordnet werden kann. Der Partialdruck entspricht dabei dem Gesamtdruck, den die Komponente beim alleinigen Ausfüllen des gesamten Volumens ausüben würde.
Unterscheidung
In der Meteorologie wird der Begriff Dampfdruck als Synonym für den Partialdruck des Wassers in der Luft verwendet. In einem Gasgemisch wie der Luft ist die Siede- bzw. Kondensationstemperatur einer Gaskomponente (z. B. Wasserdampf) diejenige, die dem Partialdruck der Komponente, nicht dem Gesamtdruck, zugeordnet ist. Sie wird in der Meteorologie auch als Taupunkt bezeichnet.
In der Biologie und Medizin sind vor allem der Sauerstoff- und Kohlenstoffdioxid-Partialdruck von großer Bedeutung. Hier wird der Begriff auch auf die Konzentrationen dieser Gase in Lösung angewendet, beispielsweise im Blut oder in Wasser. Dabei wird als Partialdruck derjenige Druck des Gases angegeben, der mit der betreffenden Konzentration in Lösung (an einer gedachten oder wirklichen Grenzfläche von Gas und Flüssigkeit) in einem Diffusionsgleichgewicht steht. Der Partialdruck wird immer dann anstatt der Massenkonzentration verwendet, wenn das Diffusionsverhalten des gelösten Gases betrachtet wird. Typische Themen dafür sind die respiratorischen Austauschvorgänge in der Lunge, die Gefahr von Gasembolien in der Tauch- und Flugmedizin sowie die Entstehung der Gasblasenkrankheit der Fische.
Dalton-Gesetz
Das Dalton-Gesetz (Daltonsches Gesetz, Gesetz der Partialdrücke), 1805 von John Dalton formuliert, besagt, dass die Summe aller Partialdrücke pi bei idealen Gasen gleich dem Gesamtdruck des Gemisches pGesamt ist. Für k Komponenten ergibt sich:
durch Umformung folgt:
Praktisch heisst das:
Löst sich ein Gas über einem Gemisch nicht oder praktisch nicht, so wird der darüber entstandene Gasraum gemäß den beiden Formeln aufgefüllt. Dabei ist der Partialdruck einer Komponente der bei dieser Temperatur herrschende Siededruck der reinen Komponente.
Hieraus leitet sich ab, dass der Partialdruck des i-ten Gases gleich dem Produkt aus Stoffmengenanteil yi des Gases mal Gesamtdruck des Gemisches (beispielsweise Luftdruck) ist. Dies ist zwar eine idealisierte Darstellung für den Fall, dass die Teilchen der Gasphase außer der mechanischen keine gegenseitige Wechselwirkung haben (ideale Gase), jedoch kann man diese im Normalfall vernachlässigen.
Das Verhältnis der Teilchenanzahl (Stoffmenge) ni einer Komponente i zur Gesamtteilchenzahl nGesamt des Gemisches entspricht hierbei dem Stoffmengenanteil yi und somit auch dem Partialdruck pi der Komponente i zum Gesamtdruck pGesamt des Gemisches. Es gilt folglich:
Beispiel: trockene Luft in Meereshöhe
Die folgende Tabelle zeigt die Zusammensetzung von vollständig trockener Luft auf Meereshöhe (Normalbedingung) also bei einem Luftdruck von 1013,25 hPa.
Man kann den Volumenanteil mit dem Teilchenanteil (Stoffmengenanteil) gleichsetzen, da es sich um annähernd ideale Gase handelt. Sonstige Bestandteile der Luft kann man aufgrund ihres geringen Anteils vernachlässigen.
Übersicht Partialdrücke trockene Luft in Meereshöhe (unter Verwendung aller üblicher Einheiten)[1] Komponente Volumenanteil % Partialdruck in hPa (mbar) kPa mmHg (Torr) bar Luft 100,00 1013,25 101,325 759,96 1,01325 Stickstoff 78,090 791,25 79,12 593,45 0,79125 Sauerstoff 20,950 212,28 21,23 159,21 0,21228 Argon 0,927 9,39 0,939 7,04 0,00939 Kohlendioxid 0,033 0,33 0,033 0,25 0,00033 Einzelnachweise
- ↑ Für feuchte Luft muss man den Wasserdampfdruck vom Luftdruck abziehen und den Restdruck unter den Gasen im Verhältnis ihrer Anteile an der trockenen Luft aufteilen.
Wikimedia Foundation.