- Atropisomerie
-
Atropisomerie ist ein Spezialfall der axialen Chiralität. Bei Atropisomeren handelt es sich um Rotamere, bei denen die Rotation um eine kovalente Einfachbindung durch sterisch anspruchsvolle Substituenten derart eingeschränkt ist, dass Konformere isoliert werden können. Nach einer Definition von M. Oki muss die Halbwertszeit der Isomerisierung (Umwandlung des einen Rotamers in das andere) bei einer gegebenen Temperatur länger als 1000 Sekunden sein.[1]
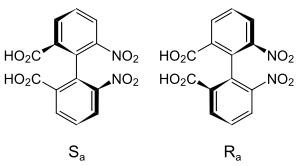
Erstmals beschrieben wurde das Phänomen "Atropisomerie" 1922 von Christie und Kenner, die die Isomere von 6,6’-Dinitro-2,2’-diphensäure trennen konnten.[2] Atropisomerie kann auch bei sterisch anspruchsvoll α-subsituierten Styrolen beobachtet werden. Enthalten solche Atropisomere noch ein zusätzliches Chiralitätszentrum, so können diastereomere Atropisomere einfach NMR-spektroskopisch nachgewiesen werden.
Stereochemie und Nomenklatur
Atropisomere sind Enantiomere, die sich trennen lassen und – wie andere Enantiomere – gewöhnlich gleiche chemische und physikalische Eigenschaften haben, mit Ausnahme des Drehwertes. In chiraler Umgebung, d. h. bei einer chemische Reaktion mit einem Enantiomer einer anderen chiralen Verbindung zeigen Atropisomere – wie andere Enantiomere – unterschiedliche Eigenschaften und Wirkungen. So sind auch die physiologischen Eigenschaften von Atropisomeren in der Regel verschieden. Hinsichtlich der Nomenklatur werden die Regeln des Cahn-Ingold-Prelog-Systems angewandt und die Konfiguration der chiralen Achse als Ra bzw. Sa beschrieben oder entsprechend der Helix-Nomenklatur mit den Deskriptoren P (Plus) bzw. M (Minus) die Stereochemie beschrieben.
Beispiele
Einzelne Verbindungen werden dazu genutzt, um als chirales Auxiliar Synthesereaktionen stereoselektiv durchzuführen. Bekannte Beispiele hierfür ist die Verwendung von BINAP oder BINOL in der asymmetrischen Synthese.
Ein praktisches Beispiel für die Bedeutung der Atropisomerie ist das Herbizid Metolachlor.[3] Ein weiteres Beispiel ist der Arzneistoff Telenzepin, bei dem Atropisomerie auftritt. Telenzepin enthält eine stereogene C–N-Bindung mit eingeschränkter freier Drehbarkeit. In neutraler wässeriger Lösung beträgt die Halbwertzeit zur Racemisierung etwa 1000 Jahre. Die Enantiomeren wurden getrennt und untersucht. Das (+)-Isomer ist etwa 500-fach aktiver als das (–)-Isomer am Muscarinrezeptors in Ratten.[4]
Einzelnachweise
- ↑ M. Oki: Recent Advances in Atropisomerism. in "Topics in Stereochemistry", 1983, Vol. 14, S. 1-81.
- ↑ Christian Wolf:Dynamic stereochemistry of chiral compounds: principles and applications. The Royal Society of Chemistry, Cambridge 2008 (Eingeschränkte Vorschau in der Google Buchsuche), S. 84 .
- ↑ H.U.-Blaser: The Chiral Switch of (S)-Metolachlor: A Personal Account of an Industrial Odyssey in Asymmetric Catalysis, Advanced Synthesis & Catalysis 2002, 344, 17-31. doi:10.1002/1615-4169(200201)344:1<17::AID-ADSC17>3.0.CO;2-8.
- ↑ J. Clayden, W. J. Moran, P. J. Edwards, S. R. LaPante: The Challange of Atropisomerism in Drug Discovery, Angew. Chem. Int. Ed. 2009, 48, 6398-6401.
Wikimedia Foundation.