- Metolachlor
-
Strukturformel 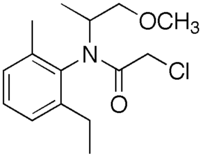
Allgemeines Name Metolachlor Andere Namen - (RS)-2-Ethyl-6-methyl-N- (1′-methyl-2′-methoxyethyl) chloracetanilid
Summenformel C15H22ClNO2 CAS-Nummer - 51218-45-2
- 87392-12-9 (S)-Metolachlor
- 178961-20-1 (R)-Metolachlor
PubChem 4169 Kurzbeschreibung in reiner Form geruchlose, farblose bis weiße Flüssigkeit[1], in technischer Form braune, ölige, sehr schwer entzündliche Flüssigkeit[2]
Eigenschaften Molare Masse 283,80 g·mol−1 Aggregatzustand flüssig
Dichte 1,12 g·cm−3[2]
Schmelzpunkt Siedepunkt Dampfdruck 0,17 Pa (20 °C)[2]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 
Gefahr
H- und P-Sätze H: 317-330 EUH: keine EUH-Sätze P: 260-280-284-310 [3] EU-Gefahrstoffkennzeichnung [2] 

Reizend Umwelt-
gefährlich(Xi) (N) R- und S-Sätze R: 43-50/53 S: 36/37/39-61 LD50 2780 mg·kg−1 (oral, Ratte)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Metolachlor ist eine chemische Verbindung aus der Gruppe der Carbonsäureamide und Chloracetanilide.
Inhaltsverzeichnis
Geschichte
Metolachlor wurde von Ciba-Geigy entwickelt. In den 1970er Jahren wurde die Wirkung von (rac)-Metolachlor beobachtet und ein Syntheseverfahren und ein Patent angemeldet. Ab 1978 wurde die Verbindung in großem Umfang (>10.000 t pro Jahr) produziert und ab 1982 die Stereoisomere in ihrer Wirkung einzeln untersucht, wobei sich die besondere Wirksamkeit von (S)-Metolachlor herausstellte. Nach einigen Versuchen mit Katalysatoren aus Rhodium- und Iridiumverbindungen wurde 1993 ein Prozess mit Iridiumferrocenyldiphosphin-Katalysator für die großtechnische Produktion entwickelt. Im gleichen Jahr lief das Patent für (rac)-Metolachlor aus und 1996 startete die großtechnische Herstellung von (S)-Metolachlor.[4] Heute stellt dieses eines der am häufigsten eingesetzten Herbizide in den USA dar. In Deutschland, Österreich und der Schweiz ist (RS)-Metolachlor in keinem zugelassenen Pflanzenschutzmittel enthalten. (S)-Metolachlor ist noch bis Ende 2015 als Herbizid zugelassen und in mehreren Pflanzenschutzmitteln enthalten.[5]
Gewinnung und Darstellung
Metolachlor wird heute durch stereoselektive Synthese gewonnen. Es kann durch Reaktion von 2-Ethyl-6-methyl-anilin mit Methoxyaceton oder 2-Brom-methoxy-propan und anschließende Reaktion mit Chloracetylchlorid gewonnen werden.[6]
Stereochemie
Metolachlor kommt in zwei enantiomeren Formen vor (R)- bzw. (S)-Metolachlor, wobei die (S)-Form die wirksamere ist. Deshalb werden seit einiger Zeit Herstellungsverfahren bevorzugt, bei welcher vermehrt die (S)-Form erzeugt wird. Diese Form wird als (S)-Metolachlor mit mehr als 80% Anteil der (S)-Form verkauft.
Eine Besonderheit besteht darin, dass sowohl das (R)- als auch das (S)-Enantiomer als Atropisomere vorliegen, es gibt also vier Stereoisomere des Metolachlors. Beide Atropisomere von (S)-Metolachlor [(αR,1' S)- und das (αS,1' S)-Isomere] haben die gleiche biologische Wirkung.[7] Andererseits sind beide Atropisomere von (R)-Metolachlor [(αR,1' R)- und (αS,1' R)-Isomer] inaktiv.[8]
Verwendung
Metolachlor wird als Herbizid (häufig auch in Kombination mit anderen Herbiziden wie z. B. Terbuthylazin oder Atrazin) gegen Gräser und Hirseunkräuter bei Mais, Sojabohnen, Erdnüssen und Baumwolle eingesetzt. Sie wirkt durch Hemmung von Elongasen und der Geranylgeranyl-Pyrophosphat (GGPP) Zyklisierungsenzyme bei Gibberellinen.
Sicherheitshinweise
Die Verwendung von Metolachlor in Dekorationsgegenständen und Spielen ist nicht zugelassen. Es wirkt auf Wasserorganismen sehr giftig.[2]
Siehe auch
Einzelnachweise
- ↑ a b Datenblatt (EXTONET).
- ↑ a b c d e f g h i Eintrag zu CAS-Nr. 51218-45-2 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ a b Datenblatt Metolachlor bei Sigma-Aldrich, abgerufen am 10. April 2011.
- ↑ H. U. Blaser; Asymmetric catalysis on industrial scale: challenges, approaches and solutions, S.68; ISBN 978-3527306312
- ↑ Nationale Pflanzenschutzmittelverzeichnisse: Schweiz, Österreich, Deutschland; abgerufen am 7. Januar 2009.
- ↑ [Thomas A. Unger; Pesticide Synthesis Handbook S. 37; ISBN 978-0815514015].
- ↑ H.U.-Blaser The Chiral Switch of (S)-Metolachlor: A Personal Account of an Industrial Odyssey in Asymmetric Catalysis, Advanced Synthesis and Catalysis 2002, 344, S. 17–31.
- ↑ Hans-Ulrich Blaser: Industrielle asymmetrische Hydrierung „Made in Switzerland“, Nachrichten aus der Chemie 58 (2010) 864−867.
Wikimedia Foundation.
