- Benzolboronsäure
-
Strukturformel 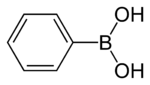
Allgemeines Name Benzolboronsäure Andere Namen - Dihydroxy(phenyl)boran
- Phenylboronsäure
Summenformel C6H7BO2 CAS-Nummer 98-80-6 PubChem 66827 Kurzbeschreibung Eigenschaften Molare Masse 121,93 g·mol−1 Schmelzpunkt Löslichkeit löslich in Wasser (10 g·l−1 bei 20 °C)[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Achtung
H- und P-Sätze H: 302 EUH: keine EUH-Sätze P: keine P-Sätze [1] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: 22-24/25 LD50 740 mg·kg-1 (Ratte, oral)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Benzolboronsäure ist eine chemische Verbindung aus der Gruppe der Organoboronsäuren.
Inhaltsverzeichnis
Gewinnung und Darstellung
Es gibt zahlreiche Methoden, um Phenylboronsäure zu synthetisieren. Eine verbreitete Synthese verwendet Phenylmagnesiumbromid und Trimethylborat zur Bildung des entsprechenden Esters, der dann durch Hydrolyse in Phenylboronsäure umgesetzt wird.[3]
- PhMgBr + B(OMe)3 → PhB(OMe)2 + MeOMgBr
- PhB(OMe)2 + H2O → PhB(OH)2 + MeOH
Eigenschaften
Benzolboronsäure ist ein farbloser bis gelblicher geruchloser Feststoff.[1][2]
Verwendung
Phenylboronsäure wird bei zahlreichen Kreuz-Kupplungsreaktionen verwendet. Im Jahr 1979 fand Miyarura und Suzuki eine Kohlenstoff-Kohlenstoff-Bindung Bildungsreaktion (heute als Suzuki-Kupplung bezeichnet) welche Arylboronsäuren mit Halogenaromaten unter katalytischer Verwendung von Palladium-Phosphan-Komplexen zu Biphenylderivaten oder Vinylaromaten umsetzen.[4]
Einzelnachweise
- ↑ a b c d e f g Datenblatt Phenylboronic acid, purum, 97.0% (HPLC) bei Sigma-Aldrich, abgerufen am 13. August 2011.
- ↑ a b c Datenblatt Benzolboronsäure bei Merck, abgerufen am 13. August 2011.
- ↑ Robert M. Washburn, Ernest Levens, Charles F. Albright, Franklin A. Billig: Benzeneboronic anhydride. In: Organic Syntheses. Coll. Vol. 4, p. 68 (1963); Vol. 39, p. 3 (1959); PDF.
- ↑ Miyaura, N.; Suzuki, A.: Stereoselective synthesis of arylated (E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst. In: J. Chem. Soc., Chem. Commun.. Nr. 19, 1979, S. 866. doi:10.1039/C39790000866.
Kategorien:- Gesundheitsschädlicher Stoff
- Borverbindung
- Aromat
Wikimedia Foundation.
