- p-v-Diagramm
-
Gemäß der Gibbsschen Phasenregel hat ein reines Fluid beziehungsweise ein Fluidgemisch mit konstanter Zusammensetzung genau zwei Freiheitsgrade. Daraus folgt, dass in der Funktion p = p(v,T) der Druck p eindeutig durch das spezifische Volumen v und die Temperatur T beschrieben wird.
Trägt man diesen Zusammenhang in ein dreidimensionales Diagramm ein, so entsteht ein p-V-T-Diagramm.
Man kann diese Oberfläche in die p-V-Ebene projizieren, wobei man das Ergebnis dieser Projektion p-v-Diagramm nennt. Hierbei ist der Druck p die Ordinate, das spezifische Volumen v die Abszisse und die Temperatur T wird je nach Anwendung für den Graphen konstant gewählt (Isotherme) oder vernachlässigt.
In dieses Diagramm werden häufig auch die Grenzen der Aggregatzustände „fest“, „flüssig“ und „gasförmig“ beziehungsweise die einzelnen Phasen des Fluids eingetragen. Es handelt sich daher bei einem p-v-Diagramm um eine spezielle Form eines Phasendiagramms.
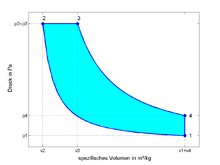
Das p-v-Diagramm wird häufig dazu verwendet um Prozessabläufe - mit oder ohne Phasenumwandlung - zu veranschaulichen, wie beispielsweise im nebenstehenden Diagramm des Diesel-Prozesses.
Verwendet man anstatt des spezifischen Volumens v das Volumen V, so spricht man auch von einem p-V-Diagramm, wobei der Bezug auf eine gleich bleibenden Stoffmenge bzw. Masse in diesem nicht integriert ist und als zusätzliche Forderung gesondert erhoben werden muss.
Siehe auch
Wikimedia Foundation.