- Gewald-Reaktion
-
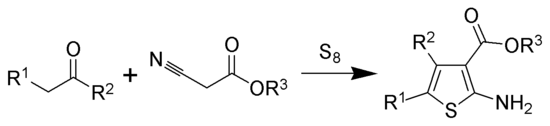
Die Gewald-Reaktion ist eine Namensreaktion in der organischen Chemie, die nach ihrem Entdecker Karl Gewald benannt ist. Dabei wird ein Keton (oder ein Aldehyd falls R2 = H) mit einem α-Cyanoester in Gegenwart von elementarem Schwefel und einer Base zu einem substituierten 2-Amino-thiophen umgesetzt.[1][2]
Reaktionsmechanismus
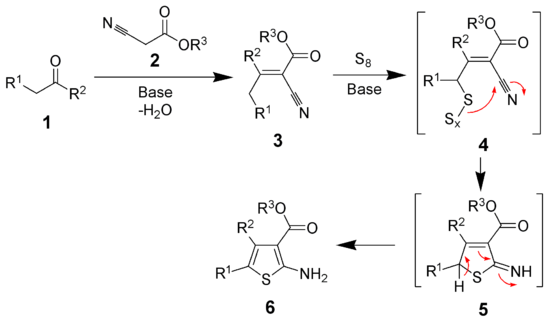
Der Reaktionsmechanismus konnte erst mehrere Jahre nach der Entdeckung der Reaktion teilweise aufgeklärt werden.[3] Der erste Schritt ist eine Knoevenagel-Kondensation zwischen dem Keton (1) und dem α-Cyanoester (2) unter Bildung des stabilen Zwischenproduktes 3. Der Mechanismus der Addition von elementarem Schwefel ist unbekannt. Es wird postuliert, dass dabei das Intermediat 4 eine Rolle spielt. Cyclisierung und Tautomerisierung liefern dann das 2-Aminothiophen (6).
Energiezufuhr mit Mikrowellen verkürzt bisweilen die Reaktionszeiten bei zugleich erhöhter Ausbeute.[4]
Varianten
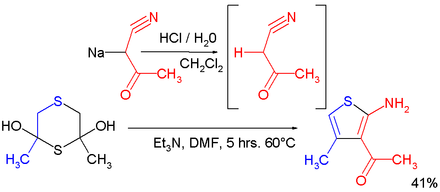
In einer Abwandlung der Gewald-Reaktion wird 3-Acetyl-2-aminothiophen erhalten, wenn man Dithian (ein Addukt aus Schwefel und Aceton) mit dem Natriumsalz von Cyanoaceton umsetzt:[5]
Einzelnachweise
- ↑ Gewald, K.; Schinke, E.; Böttcher, H. Chemische Berichte 1966, 99, 94-100.
- ↑ Sabnis, R. W. Sulfur Reports 1994, 16, 1-17.
- ↑ Sabnis, R. W.; Rangnekar, D. W.; Sonawane, N. D. J. Heterocyclic Chem. 1999, 36, 333.
- ↑ Sridhar, M.; Raoa, R. M.; Babaa, N. H. K.; Kumbhare, R. M. Tetrahedron Lett. 2007, 48, 3171-3172, (doi:10.1016/j.tetlet.2007.03.052).
- ↑ Gernot A. Eller, Wolfgang Holzer Molecules 2006, 11, 371-376 Online article.
Wikimedia Foundation.