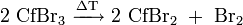- CfBr3
-
Kristallstruktur 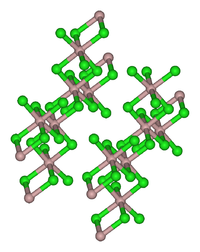
Kristallgitter des Californium(III)-bromids (AlCl3-Typ)Kristallsystem monoklin Allgemeines Name Californium(III)-bromid Andere Namen Californiumtribromid
Verhältnisformel CfBr3 CAS-Nummer 20758-68-3 Kurzbeschreibung grüne monokline Kristalle Eigenschaften Molare Masse 490,792 g/mol Aggregatzustand fest
Schmelzpunkt 675 °C[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Californium(III)-bromid ist ein Bromid des künstlichen Elements und Actinoids Californium mit der Summenformel CfBr3. In diesem Salz tritt Californium in der Oxidationsstufe +3 auf.
Eigenschaften
Californium(III)-bromid ist ein grüner Feststoff.[3] Bei zunehmenden Temperaturen zersetzt es sich teilweise zum Californium(II)-bromid (CfBr2):
Californium(III)-bromid kristallisiert sowohl im AlCl3- als auch im FeCl3-Typ. Im ersten Fall ist das Cf-Ion sechsfach koordiniert und die drei voneinander unabhängigen Cf-Br-Bindungslängen betragen 279,5 ± 0,9 pm, 282,7 ± 1,1 pm und 282,8 ± 0,8 pm.[4]
Obwohl sich durch zunehmende Temperatur der Anteil des zweiwertigen Californiums vergrößert, konnte nur die monokline Struktur (AlCl3-Typ) für das CfBr3 nachgewiesen werden.[5]
Beim radioaktiven Zerfall des Berkeliumisotops 249Bk zu 249Cf bleiben Oxidationszahl und die jeweilige Kristallstruktur erhalten. Das sechsfach koordinierte BkBr3 (AlCl3-Typ, monokline Struktur) erzeugt ein sechsfach koordiniertes CfBr3; das achtfach koordinierte BkBr3 (PuBr3-Typ, orthorhombische Struktur) erzeugt ein achtfach koordiniertes CfBr3, eine zuvor unbekannte Form des CfBr3.[6]
Die Lösungsenthalpie von Californium(III)-bromid in 1 M Salzsäure (bei 298,15 ± 0,05 K und p0 = 101.325 kPa) wurde mit −(181,4 ± 0,9) kJ·mol−1 gemessen. Zusammen mit den Ergebnissen der Lösungsenthalpie von Californium-Metall konnte die Standardbildungsenthalpie (ΔfH0) auf −(752,5 ± 3,2) kJ·mol−1 bestimmt werden.[7]
Literatur
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
Einzelnachweise
- ↑ Californium(III)-bromid bei www.webelements.com.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Californiumbromid (CfBr3): Der Kristall zeigt grüne Farbe.
- ↑ John H. Burns, J. R. Peterson, J. N. Stevenson: "Crystallographic Studies of Some Transuranic Trihalides: 239PuCl3, 244CmBr3, 249BkBr3 and 249CfBr3", in: J. Inorg. Nucl. Chem. 1975, 37 (3), 743–749; doi:10.1016/0022-1902(75)80532-X.
- ↑ J. P. Young, K. L. Vander Sluis, G. K. Werner, J. R. Peterson, M. Noé: "High Temperature Spectroscopic and X-Ray Diffraction Studies of Californium Tribromide: Proof of Thermal Reduction to Californium (II)", in: J. Inorg. Nucl. Chem. 1975, 37 (12), 2497–2501; doi:10.1016/0022-1902(75)80878-5.
- ↑ J. P. Young, R. G. Haire, J. R. Peterson, D. D. Ensor, R. L. Fellows: "Chemical Consequences of Radioactive Decay. 1. Study of 249Cf Ingrowth into Crystalline 249BkBr3: A New Crystalline Phase of CfBr3", in: Inorg. Chem. 1980, 19 (8), 2209–2212; doi:10.1021/ic50210a003.
- ↑ J. Fuger, R. G. Haire, W. R. Wilmarth, J. R. Peterson: "Molar Enthalpy of Formation of Californium Tribromide", in: Journal of the Less Common Metals 1990, 158 (11), 99–104; doi:10.1016/0022-5088(90)90435-M.
Wikimedia Foundation.