- Natriumthioantimonat(V)
-
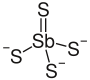
Strukturformel 
Allgemeines Name Natriumthioantimonat(V) Andere Namen - Natriumtetrathioantimonat(V)-Nonahydrat
- Schlippe'sches Salz
Summenformel Na3SbS4·9 H2O CAS-Nummer 10101-91-4 PubChem 16211194 Kurzbeschreibung hellgelbe Kristalle mit unangenehmem Geruch[1]
Eigenschaften Molare Masse 481,10 g·mol−1 Aggregatzustand fest
Dichte 1,86 g·cm−3[1]
Schmelzpunkt 87 °C[1]
Siedepunkt 234 °C (Zersetzung)[1]
Löslichkeit gut in Wasser (330 g·l−1 bei 20 °C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 

Achtung
H- und P-Sätze H: 332-302-411 EUH: keine EUH-Sätze P: 273 [1] EU-Gefahrstoffkennzeichnung [1] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 20/22-51/53 S: 61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumthioantimonat(V) (auch Schlippe'sches Salz nach dem Chemiker Johann Karl Friedrich von Schlippe[2], von diesem ursprünglich als Schwefelspießglanznatron bezeichnet) ist das Natriumsalz der Thioantimon(V)-säure und tritt kristallwasserhaltig als Nonahydrat mit der Summenformel Na3SbS4· 9 H2O auf.
Inhaltsverzeichnis
Gewinnung und Darstellung
Natriumthioantimonat(V)-Nonahydrat wird bei Erhitzung einer wässrigen Suspension von Stibnit mit Natronlauge und Schwefel gebildet. Hierbei wird die Antimon(III)-Verbindung des Stibnits zu einer Antimon(V)-Verbindung oxidiert und der Schwefel zu Sulfid reduziert.[3] Nach Abkühlung der Lösung kristallisiert das hellgelbe Schlippe'sche Salz aus. Die Gleichung für diese Reaktion lautet:

Eine alternative Darstellungsmethode geht von in Salzsäure gelöstem Antimon(III)-chlorid SbCl3 oder Antimon(III)-oxid Sb2O3 aus, in das Schwefelwasserstoffgas eingeleitet wird.[4]Eigenschaften
Natriumthioantimonat(V) liegt in Form von licht- und luftempfindlichen, hellgelben Kristallen mit unangenehmem Geruch vor. In Wasser ist es sehr leicht löslich, wobei seine wässrige Lösung stark alkalisch reagiert.[1] Mit Säuren erhält man daraus das als Pigment Goldschwefel verwendete Antimon(V)-sulfid, Sb2S5.
Verwendung
Natriumthioantimonat(V) wird zur Herstellung von Einkristallen[1] und Antimon(V)-sulfid (auch Goldschwefel genannt) verwendet.
Einzelnachweise
- ↑ a b c d e f g h i j Datenblatt Natriumthioantimonat(V)-Nonahydrat bei Merck, abgerufen am 14. April 2011.
- ↑ Schweiggers Journal 1822, Nr. 33
- ↑ A.F. Hollemann, E. Wiberg: Lehrbuch der Anorganischen Chemie, 91.-100. Auflage, Walter de Gruyter Verlag, Berlin, 1985. ISBN 3-11-012641-9 (Eingeschränkte Vorschau in der Google Buchsuche), S. 821
- ↑ G. Jander, E. Blasius: Einführung in das anorganisch chemische Praktikum (qualitative Analyse), 13. Auflage, S. Hirzel Verlag, Stuttgart 1990, ISBN 3-7776-0449-6, S. 482.
Kategorien:- Gesundheitsschädlicher Stoff
- Umweltgefährlicher Stoff
- Salz
- Antimonverbindung
- Schwefelverbindung
- Natriumverbindung
Wikimedia Foundation.
