- Chemokin
-
Chemokine (Name abgeleitet aus chemotaktische Zytokine), sind eine Gruppe der Zytokine, also kleine Signalproteine, die bei Zellen eine Wanderungsbewegung (Chemotaxis) auslösen. Die Zellen bewegen sich dabei entlang eines Konzentrationsgradienten zum Ort der höchsten Chemokinkonzentration. Chemokine spielen eine zentrale Rolle bei der Migration von Immunzellen im Gewebe und bei deren Auswanderung aus dem Blut. Manche Chemokine wirken zusätzlich aktivierend auf Immunzellen, und einige sind an der Organentwicklung und der Angiogenese beteiligt. Die ungefähr 50 unterschiedlichen Chemokine werden von Immunzellen und vielen Gewebezellen produziert. Ihre Wirkung entfalten sie nach Bindung an Chemokinrezeptoren, die im Immunsystem weit verbreitet sind. Ohne die von Chemokinen ausgelöste Zellwanderung könnte das Immunsystem nicht funktionieren.
Inhaltsverzeichnis
Struktur und Nomenklatur
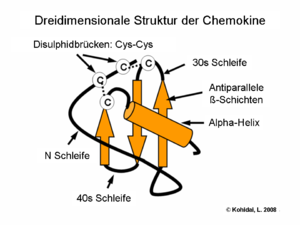
Chemokine sind kleine Proteine, die aus ca. 75–125 Aminosäuren bestehen und eine Molmasse von 8 bis 14 kDa aufweisen. Die Aminosäuresequenz ist innerhalb der Chemokinfamilie unterschiedlich konserviert, die Homologie kann weniger als 20 % oder auch mehr als 90 % betragen. Die räumliche Faltung oder Tertiärstruktur hingegen ist streng konserviert: der Amino-Terminus ist ungeordnet, der Hauptkörper wird durch ein dreisträngiges antiparalleles β-Faltblatt gebildet, und der Carboxy-Terminus endet mit einer α-Helix.[1] Ein weiteres konserviertes Merkmal der Chemokine ist eine Gruppe von Cysteinresten, die eine oder zwei Disulfidbrücken ausbilden können.
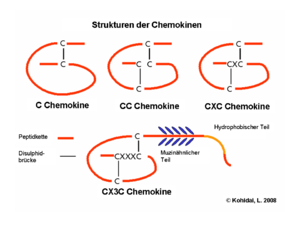
Aus der Anzahl und Position der Cysteinreste am Amino-Terminus leitet sich die systematische Nomenklatur der Chemokine ab [2]. Vier Unterfamilien lassen sich so unterscheiden: Bei den CC-Chemokinen folgen die ersten beiden Cysteine direkt aufeinander, bei den CXC-Chemokinen sind sie durch eine Aminosäure voneinander getrennt, und bei den CX3C-Chemokinen durch drei Aminosäuren. Bei diesen Chemokinfamilien werden immer zwei Disulfidbrücken gebildet. Im Gegensatz dazu gibt es bei der C-Familie nur ein konserviertes Cystein am Amino-Terminus, und es wird auch nur eine Disulfidbrücke ausgebildet. Die systematischen Namen der einzelnen Chemokine setzen sich aus der Bezeichnung der Familie (CC, CXC, CX3C, XC), dem Buchstaben L für Ligand und einer fortlaufenden Nummerierung zusammen. Daneben werden aber noch häufig die Bezeichnungen verwendet, die ihnen bei der Erstbeschreibung gegeben wurde.
Funktion
Die Hauptfunktion der Chemokine besteht in der Auslösung von Chemotaxis bei Immunzellen. Es lassen sich inflammatorische (oder induzierbare) und homöostatische (oder konstitutive) Chemokine unterscheiden. Die meisten Chemokine sind inflammatorische Zytokine: Ihre Produktion wird z.B. durch eine Verletzung, Infektion oder Entzündung ausgelöst, und ihre Freisetzung lockt Immunzellen an. Sie wirken also wie ein Alarmsignal. Die homöostatischen Chemokine im Gegenteil werden ständig produziert und sind an der Organisation von lymphoiden Organen und der Überwachung von gesundem Gewebe beteiligt. Zu dieser Gruppe gehören CCL18, CCL19, CCL21, CXCL12, CXCL13 und CXCL14. Eine andere Gruppe von Chemokinen kann nicht eindeutig einer der beiden Kategorien zugeordnet werden; dies sind CCL1, CCL17, CCL20, CCL22, CCL25, CXCL9, CXCL10, CXCL11 und CXCL16.
Die Funktion der Chemokine ist nicht zwingend an Formen gebunden, die frei löslich in der Gewebeflüssigkeit oder im Blut schwimmen. Konzentrationsgradienten werden auch durch eine feste Bindung an Gewebestrukturen ausgebildet. Chemokine besitzen viele basische Aminosäuren und sind daher positiv geladen; dies ermöglicht eine feste Bindung an negativ geladenen Zuckermoleküle (Glykosaminoglykane), die auf der Oberfläche von Zellen und bei Proteinen der extrazellulären Matrix weit verbreitet sind. Einige Chemokine wie CCL2, CCL3 und CCL5 verlieren ihre Funktion im Körper, wenn eine Bindung an Glykosaminoglykane nicht mehr möglich ist. Der genaue Zusammenhang zwischen Bindung an Gewebestrukturen und Funktion wird allerdings noch nicht verstanden.
Familien
CC Chemokine Name Gene Andere Name(n) Uniprot CCL1 Scya1 I-309, TCA-3 P22362 CCL2 Scya2 MCP-1 P13500 CCL3 Scya3 MIP-1α P10147 CCL4 Scya4 MIP-1β P13236 CCL5 Scya5 RANTES P13501 CCL6 Scya6 C10, MRP-2 P27784 CCL7 Scya7 MARC, MCP-3 P80098 CCL8 Scya8 MCP-2 P80075 CCL9/CCL10 Scya9 MRP-2, CCF18, MIP-1γ P51670 CCL11 Scya11 Eotaxin P51671 CCL12 Scya12 MCP-5 Q62401 CCL13 Scya13 MCP-4, NCC-1, Ckβ10 Q99616 CCL14 Scya14 HCC-1, MCIF, Ckβ1, NCC-2, CCL Q16627 CCL15 Scya15 Leukotactin-1, MIP-5, HCC-2, NCC-3 Q16663 CCL16 Scya16 LEC, NCC-4, LMC, Ckβ12 O15467 CCL17 Scya17 TARC, dendrokine, ABCD-2 Q92583 CCL18 Scya18 PARC, DC-CK1, AMAC-1, Ckβ7, MIP-4 P55774 CCL19 Scya19 ELC, Exodus-3, Ckβ11 Q99731 CCL20 Scya20 LARC, Exodus-1, Ckβ4 P78556 CCL21 Scya21 SLC, 6Ckine, Exodus-2, Ckβ9, TCA-4 O00585 CCL22 Scya22 MDC, DC/β-CK O00626 CCL23 Scya23 MPIF-1, Ckβ8, MIP-3, MPIF-1 P55773 CCL24 Scya24 Eotaxin-2, MPIF-2, Ckβ6 O00175 CCL25 Scya25 TECK, Ckβ15 O15444 CCL26 Scya26 Eotaxin-3, MIP-4α, IMAC, TSC-1 Q9Y258 CCL27 Scya27 CTACK, ILC, Eskine, PESKY, skinkine Q9Y4X3 CCL28 Scya28 MEC Q9NRJ3 CXC Chemokine Name Gene Andere Name(n) Uniprot CXCL1 Scyb1 Gro-α, GRO1, NAP-3 P09341 CXCL2 Scyb2 Gro-β, GRO2, MIP-2α P19875 CXCL3 Scyb3 Gro-γ, GRO3, MIP-2β P19876 CXCL4 Scyb4 PF-4 P02776 CXCL5 Scyb5 ENA-78 P42830 CXCL6 Scyb6 GCP-2 P80162 CXCL7 Scyb7 NAP-2, CTAPIII, β-Ta, PEP P02775 CXCL8 Scyb8 IL-8, NAP-1, MDNCF, GCP-1 P10145 CXCL9 Scyb9 MIG, CRG-10 Q07325 CXCL10 Scyb10 IP-10, CRG-2 P02778 CXCL11 Scyb11 I-TAC, β-R1, IP-9 O14625 CXCL12 Scyb12 SDF-1, PBSF P48061 CXCL13 Scyb13 BCA-1, BLC O43927 CXCL14 Scyb14 BRAK, bolekine O95715 CXCL15 Scyb15 Lungkine, WECHE Q9WVL7 CXCL16 Scyb16 SRPSOX Q9H2A7 CXCL17 VCC-1 DMC, VCC-1 Q6UXB2 C Chemokine Name Gene Andere Name(n) Uniprot XCL1 Scyc1 Lymphotactin α, SCM-1α, ATAC P47992 XCL2 Scyc2 Lymphotactin β, SCM-1β Q9UBD3 CX3C Chemokine Name Gene Other name(s) Uniprot CX3CL1 Scyd1 Fractalkine, Neurotactin, ABCD-3 P78423 CC-Familie
Beim Menschen hat diese Familie 24 Mitglieder, ihre Wirkung entfalten sie bevorzugt auf Neutrophilen und T-Zellen.
CXC-Familie
Die insgesamt 16 bekannten CXC-Chemokine des Menschen können durch die Ab- oder Anwesenheit weiterer struktureller Merkmale, wie beispielsweise das aus drei Aminosäuren bestehende ELR-Motiv, unterteilt werden. ELR-positive CXC-Chemokine gelten als potente Promotoren der Angiogenese, während ELR-negative CXC-Chemokine zumeist eine antiangiogenetische Wirkung besitzen[3]. Die Rezeptoren für diese Chemokine finden sich oft auf Monozyten, Eosinophilen, Basophilen und T-Zellen.
CX3C-Familie
Das vor kurzem klonierte Chemokin „Fraktalkin“ (Bazan et al., 1997) ist das einzige Mitglied dieser Familie. Charakteristisch für Fraktalkin ist ein CX3C-Motiv und die Expression der Chemokindomäne über einen mucinähnlichen, membranverankerten Proteinstrang. Das Gen, das für das CX3C-Chemokin kodiert, ist auf dem Chromosom 16 lokalisiert. Fraktalkin wird membranständig auf aktivierten Endothelzellen exprimiert und kann in die Umgebung sezerniert werden. Sie kommen also als membrangebundene oder lösliche Moleküle vor. Fraktalkine wirken auf T-Lymphozyten und Monozyten. Lösliche Fraktalkine regulieren die Leukozytenmigration. Die membranständige Form vermittelt eine verstärkte Adhärenz der T-Zellen und Monozyten. Somit sind Fraktalkine in der Lage, direkt auf den Schritt der Leukozytenextravasation einzuwirken, bei dem die Zelle vom Rollen am Endothel in eine feste Adhäsion überführt wird, der die anschließende Diapedese ins Gewebe folgt. Außerdem ist die Expression der Fraktalkine im Gehirn beobachtet worden (Pan et al., 1997). Sie findet sich auf aktivierten Mikrogliazellen, was darauf schließen lässt, dass es bei Entzündungsprozessen im zentralen Nervensystem eine Rolle spielt. Außerdem wird die Chemotaxis und Aktivierung von neutrophilen Granulozyten im Gehirn von Fraktalkinen beeinflusst.
C-Familie
XCL1 (auch Lymphotactin oder ATAC) wird vor allem von aktivierten CD8 T-Zellen und von NK-Zellen freigesetzt. Beim Menschen gibt es noch ein zweites Gen (XCL2), das bis auf zwei Aminosäuren identisch mit XCL1 ist.
Literatur
- Charles A. Janeway, Paul Travers, Mark Walport: Immunobiology. B&T; 6. Auflage (2005), ISBN 0-8153-4101-6
- S. J. Allen et al.: Chemokine: receptor structure, interactions, and antagonism. In: Annu.Rev.Immunol. Bd. 25, 2007, S. 787-820. Abstract
Einzelnachweise
- ↑ E. J. Fernandez et al.: Structure, function, and inhibition of chemokines. In: Annu.Rev.Pharmacol.Toxicol. Bd. 42, 2002, S. 469-499. Abstract
- ↑ A. Zlotnik et al.: Chemokines: a new classification system and their role in immunity. In: Immunity. Bd. 12, Nr. 2, 2000, S. 121-127. Abstract
- ↑ Strieter RM, Polverini PJ, Kunkel SL, et al: The functional role of the ELR motif in CXC chemokine-mediated angiogenesis. In: J. Biol. Chem.. 270, Nr. 45, November 1995, S. 27348–57. PMID 7592998.
Wikimedia Foundation.