- Zinn(II)-hydroxid
-
Strukturformel 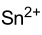
Allgemeines Name Zinn(II)-hydroxid Andere Namen Zinndihydroxid
Summenformel Sn(OH)2 CAS-Nummer 12026-24-3 Kurzbeschreibung weißes, amorphes Pulver [1]
Eigenschaften Molare Masse 152,716 g·mol−1 Aggregatzustand fest [1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Zinn(II)-hydroxid (Zinndihydroxid) ist eine stabile anorganische Verbindungen des Zinns mit der Oxidationsstufe II. Das Hydroxid ist amphoter, da es sowohl mit starken Säuren wie auch mit starken Basen reagiert. Mit starken Säuren bildet das Hydroxid die Zinn(II)-salze und mit starken Laugen die Stannate(II), veraltet Stannite genannt. Letztere sind damit Salze einer Zinn(II)-säure, die sowohl Tri-[Sn(OH)3]−– wie auch Tetra-hydroxozinn(II)-[Sn(OH)4]2−–Verbindungen bildet.[3]
Inhaltsverzeichnis
Gewinnung, Darstellung und Eigenschaften
Bei der Zugabe von verdünntem Alkalihydroxid zu Zinn(II)-salzlösungen wird ein weißer Niederschlag eines Zinn(II)-oxidhydrates gebildet, das in Wasser schwer löslich ist. Die Gleichung für die Bildung des reinen Hydrats ist wie folgt:
Für die Oxidhydrate werden unterschiedliche Zusammensetzungen angegeben, deren Formeln aber alle umstritten sind. Nachfolgend einige Beispiele dafür aus der Literatur[4]:
- 2SnO·H2O
- 3SnO·H2O
- 3SnO·2H2O
- 5SnO·2H2O
Das reine Zinn(II)-hydroxid konnte erst 1976[5]: über eine Organozinnverbindung 2R3SnOH mittels Hydrolyse bei Anwesenheit von Zinn(II)-chlorid hergestellt werden.
Wird Zinn(II)-hydroxid in einer sauerstofffreien Atmosphäre erhitzt so bildet sich ein blauschwarzes Pulver, das Zinn(II)-oxid[6]. Nachfolgend die Reaktionsgleichung:
Wie alle Zinn(II)-verbindungen ist auch das Hydroxid ein Reduktionsmittel und oxidiert leicht zu einer Zinn(IV)-verbindung.
In starken Basen löst sich das Oxidhydrat zu den Alkalistannaten(II). Die Reaktionsgleichung für die Reaktion mit Natriumhydroxid zu Natriumstannat(II) ist wie folgt:
Weblinks
Einzelnachweise
- ↑ a b David R. Lide, Mary Lide: CRC Handbook of Chemistry and Physics. 87. Auflage, CRC Press, 1998, ISBN 9780849305948, S. 4/95
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Hollemann-Wiberg,Verlag Walter de Gruyter&Co, 37.–39. Auflage, 1956, S. 354
- ↑ W.D.Honnik und J.J.Zuckermann lt. angegebenen Weblink
- ↑ W.D.Honnik und J.J.Zuckermann lt. angegebenen Weblink
- ↑ Hollemann-Wiberg,Verlag Walter de Gruyter&Co, 37.–39. Auflage, 1956, S. 354
Literatur
- Hollemann-Wiberg, Verlag Walter de Gruyter&Co, 37.–39. Auflage, 1956, S. 353–54
- Jander-Wendt, S.Hirzel Verlag Sttg., 3. Auflage, 1959
Wikimedia Foundation.



