- Zinn(II)-chlorid
-
Kristallstruktur 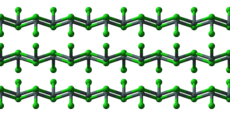
Allgemeines Name Zinn(II)-chlorid Andere Namen - Zinndichlorid
- Zinnchlorür
- Einfach-Chlorzinn
- Stannochlorid (Dihydrat)
Verhältnisformel - SnCl2 (wasserfrei)
- SnCl2 · 2 H2O (Dihydrat)
CAS-Nummer - 7772-99-8 (wasserfrei)
- 10025-69-1 (Dihydrat)
Kurzbeschreibung weiße rhombische Kristalle[1]
Eigenschaften Molare Masse 189,61 g·mol−1 (wasserfrei) Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt 622–624 °C (wasserfrei)[2]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 302-315-317-319-335 EUH: keine EUH-Sätze P: 280-302+352-305+351+338 [2] EU-Gefahrstoffkennzeichnung [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36/37/38-43 S: 24-26-37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Zinn(II)-chlorid (veraltet: Zinnchlorür) ist ein Chlorid des Zinns, das Zinnsalz der Salzsäure. Es bildet farblose oder grauweiße, fettig glänzende Kristalle.
Inhaltsverzeichnis
Darstellung
Wasserfreies Zinn(II)-chlorid erhält man durch Erhitzen von Zinn in Chlorwasserstoff:
Aus wässriger Lösung fällt das Dihydrat aus.
In Sodafabriken füllt man granuliertes Zinn in irdene Gefäße und leitet Salzsäuredämpfe aus den Sulfatöfen ein, worauf man die abgelassene Lösung von Zinn(II)-chlorid zur Kristallisation bringt. Auch aus Weißblechabfällen, die drei bis fünf Prozent Zinn enthalten, wird Zinn(II)-chlorid mit Salzsäuredämpfen gewonnen.
Zinn(II)-chlorid kommt als feste Salzmasse oder in Lösung mit überschüssiger Salzsäure in den Handel. Es ist farblos, schmeckt unangenehm metallisch, wird an der Luft feucht, schmilzt bei 40 °C, wird bei 100 °C völlig oder beinahe wasserfrei und bildet bei schnellem Erhitzen auf 100 °C Oxidchlorid, aus dem bei höherer Temperatur wasserfreies Zinn(II)-chlorid abdestilliert.
Es löst sich leicht in Alkohol und in wenig Wasser, gibt mit mehr Wasser ein saures Chlorid und unlösliches, weißes, basisches Zinn(II)-chlorid und nur bei Gegenwart von Salzsäure, Weinsäure oder Salmiak eine klare Lösung. Die Kristalle und die Lösung absorbieren an der Luft Sauerstoff unter Bildung von unlöslichem, weißem Oxichlorid, das in Gegenwart von Salzsäure und Zinn wieder reduziert wird.
Eigenschaften
In reinem Zustand schmilzt kristallines Zinn(II)-chlorid bei 247 °C. Das Zinn(II)-chlorid-dihydrat schmilzt bei 40 °C und verdampft bei höherer Temperatur unter Zersetzung. Zinn(II)-chlorid zeigt unter UV-Licht eine blaue Fluoreszenz.
Zinnspäne lösen sich in warmer Salzsäure, und die Lösung gibt beim Verdampfen große, durchsichtige Kristalle von Zinn(II)-chlorid-dihydrat. Dieses Zinnsalz wird großtechnisch dargestellt, indem Zinn in Salzsäure gelöst wird, wobei das Metall stets im Überschuss vorhanden sein muss, da die Lösung bei Gegenwart von etwas granuliertem Zinn bis 75 oder 78 °C verdampft und das Salz zur Kristallisation bringt.
Zinn(II)-chlorid ist ein starkes Reduktionsmittel. Silber- und Quecksilbersalze zu den Metallen reduziert. Weiterhin kann es Eisen(III)-salze zu Eisen(II)-salzen oder Chromate zu Chrom(III)-salzen reduzieren [3].
Da Zinn(II)-Ionen amphoter sind, kann sich in alkalischen bis leicht sauren Lösungen das Zinnhydroxychlorid (basisches Zinnchlorid) bilden:
Das sog. basische Zinnchlorid ist kaum wasserlöslich. Diese Reaktion ist der Grund für das Eintrüben von wäßrigen Zinnchloridlösungen. Durch ein leichtes Ansäuern z.B. mit Salzsäure oder Weinsäure kann das Ausfällen des Hyrdoxychlorides verhindert werden.
Durch Luftsauerstoff erfolgt in wässriger bzw. salzsaurer Lösung leicht die Oxidation zu Zinn(IV)-chlorid. Die sauren Bedingungen verhindern das Ausfallen des basisches Zinnsalzes:
Verwendung
Zinn(II)-chlorid wird im Labor als Reduktionsmittel verwendet. In der Galvanik dient es zur elektrolytischen Verzinnung.
Zinn(II)-chlorid dient in der chemischen Analyse, in der Färberei zur Reduktion des Indigos und von Eisen- und Manganoxid auf Zeugen, als Beizmittel, namentlich zum Färben mit Cochenille, zum Avivieren und Rosieren, auch zur Darstellung von Goldpurpur und Lackfarben, als Antichlor und zum Entfernen von Rostflecken aus Wäsche.
Zinn(II)-chlorid dient als Lösung mit konzentrierter Salzsäure unter dem Namen Bettendorfs Reagenz als Nachweismittel für Arsen und Quecksilber[4]. Dabei kommt es zu einer Braunfärbung der Lösung, da Zinn(II)-chlorid die Arsenverbindung reduziert und so elementares Arsen ausfällt. Die Reaktion wird Bettendorfsche Probe genannt.
In der Lebensmitteltechnik wird es als Antioxidationsmittel, Säuerungsmittel und Stabilisator eingesetzt, wobei es Verfärbungen bei weißen Gemüsekonserven (z.B. Spargel) verhindert. In der EU ist es als Lebensmittelzusatzstoff der Nummer E 512 ausschließlich für Spargelkonserven in Gläsern oder Dosen mit einer Höchstmengenbeschränkung von 25 mg/kg für den Zinnanteil im Endprodukt zugelassen. Es gilt in den üblichen Mengen als gesundheitlich unbedenklich, in großen Mengen sind jedoch Magenreizungen möglich.[5]
Einzelnachweise
- ↑ a b Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f g h Eintrag zu Zinn(II)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10.11.2007 (JavaScript erforderlich)
- ↑ http://www.seilnacht.com/Chemie/ch_sncl2.htm
- ↑ http://www.panreac.com/new/esp/fds/Ale/X171552.htm
- ↑ zusatzstoffe-online.de
Weblinks
ZinnhalogenideZinn(II)-fluorid | Zinn(II)-chlorid | Zinn(II)-bromid | Zinn(II)-iodid
Zinn(IV)-fluorid | Zinn(IV)-chlorid | Zinn(IV)-bromid | Zinn(IV)-iodid
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Zinn-II-Chlorid — Strukturformel Keine Strukturformel vorhanden Allgemeines Name Zinn(II) chlorid Andere Namen Zinndichlorid Zinnchlorür Einfach Chlorzinn Stannochlorid (Dihydrat) Summenformel … Deutsch Wikipedia
Zinn(IV)-chlorid — Strukturformel Allgemeines Name Zinn(IV) chlorid Andere Namen … Deutsch Wikipedia
Zinn(IV)chlorid — Strukturformel Keine Strukturformel vorhanden Allgemeines Name Zinn(IV) chlorid Andere Namen Zinnchlorid Zinntetrachlorid Stannichlorid Summenformel SnCl4 … Deutsch Wikipedia
Zinn-IV-chlorid — Strukturformel Keine Strukturformel vorhanden Allgemeines Name Zinn(IV) chlorid Andere Namen Zinnchlorid Zinntetrachlorid Stannichlorid Summenformel SnCl4 … Deutsch Wikipedia
Zinn — Eigenschaften … Deutsch Wikipedia
Zinn(IV)-iodid — Kristallstruktur Sn4+ … Deutsch Wikipedia
Zinn(II)-fluorid — Kristallstruktur Sn2+: F … Deutsch Wikipedia
Zinn(IV)oxid — Kristallstruktur Allgemeines Name Zinn(IV) oxid Andere Namen Zinnasche Zinnblüten Zin … Deutsch Wikipedia
Zinn(II)-sulfid — Kristallstruktur Sn2+ S2 … Deutsch Wikipedia
Zinn(IV)-sulfid — Strukturformel Allgemeines Name Zinn(IV) sulfid Andere Namen … Deutsch Wikipedia





