- Adiabatische Näherung
-
Die Born-Oppenheimer-Näherung oder Born-Oppenheimer-Approximation oder adiabatische Näherung ist eine Methode zur Lösung der Schrödingergleichung für ein System mit mehreren schweren und wenigstens einem leichten Teilchen. Dieses Problem tritt bei der quantenmechanischen Behandlung von Molekülen auf, da diese aus mindestens zwei Atomkernen und einer Vielzahl von sehr viel leichteren Elektronen bestehen. Schon für das einfachste Molekül, das
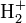 -Ion, ist eine analytisch exakte Lösung der Schrödinger-Gleichung für das Elektron und die zwei Kerne nicht mehr möglich, eine Näherung also unumgänglich. Die Born-Oppenheimer-Approximation ist benannt nach Max Born und J. Robert Oppenheimer, welche diese Vorgehensweise erstmals 1927 in den Annalen der Physik veröffentlichten[1]
-Ion, ist eine analytisch exakte Lösung der Schrödinger-Gleichung für das Elektron und die zwei Kerne nicht mehr möglich, eine Näherung also unumgänglich. Die Born-Oppenheimer-Approximation ist benannt nach Max Born und J. Robert Oppenheimer, welche diese Vorgehensweise erstmals 1927 in den Annalen der Physik veröffentlichten[1]Inhaltsverzeichnis
Prinzip
Die Vereinfachung beruht auf der Annahme, dass man die Bewegung der Kerne von der Bewegung der Elektronen trennen kann. Dies wird nahe gelegt durch den großen Massenunterschied, der zu einer größeren Trägheit der Kerne führt. Da alle Teilchen untereinander hauptsächlich durch Coulomb-Kräfte wechselwirken, die im Wesentlichen gleich stark sind, werden die Elektronen viel stärker beschleunigt als die Kerne.
Die Näherung besteht bildlich gesprochen darin, zunächst die Kerne als ortsfest zu betrachten. Daraus ergibt sich ein Potenzial für die Elektronenbewegung. Man versucht nun, die Wellenfunktion der Elektronen in diesem Zustand und deren Energie (im Allgemeinen näherungsweise) zu berechnen. Dazu addiert man die Energie der Kerne in der betrachteten Anordnung. So erhält man eine Gesamtenergie für das System. Dann variiert man die Anordnung der Kerne, erhält wieder eine Gesamtenergie usw. Die Gesamtenergie in Abhängigkeit von der Anordnung der Kerne verwendet man dann als Potenzial, in dem man die Kernbewegung berechnen kann.
Mathematische Formulierung
Die Voraussetzung für diese Annäherung besteht in der Annahme, dass die Elektronenbewegung und die Kernbewegung getrennt werden können. Diese Annahme führt zu einer molekularen Wellengleichung, die aus einem Produkt der Elektronen-Wellenfunktion Ψel und der Kern-Wellenfunktion Ψn besteht:
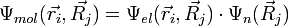
Weiter trifft man die Annahmen, dass:
- Ψel von den Kernpositionen
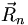 abhängt, aber nicht von deren Geschwindigkeiten. D.h., die Kernbewegung ist so viel kleiner als die Elektronenbewegung, dass sie als fest angenommen werden kann und nur als Parameter einfließt
abhängt, aber nicht von deren Geschwindigkeiten. D.h., die Kernbewegung ist so viel kleiner als die Elektronenbewegung, dass sie als fest angenommen werden kann und nur als Parameter einfließt - und somit die Kernwellenfunktion nur von der Kernkoordinate
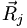 abhängt.
abhängt.
Wendet man nun den Hamilton-Operator (
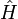 ) auf die gesamte Wellenfunktion an, so bekommt man zwei getrennte Ausdrücke:
) auf die gesamte Wellenfunktion an, so bekommt man zwei getrennte Ausdrücke:- einen für die Bewegung der Elektronen
Elektronen-Schrödingergleichung:
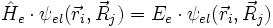
- und einen für die Kernbewegung
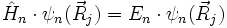
Zusammengefasst:
Die große Differenz der relativen Massen zwischen Elektronen und Kernen erlaubt es also, die Wellenfunktion in eine Elektronen-Wellengleichung und eine Kern-Wellengleichung zu trennen.
Vorgehensweise
Für verschiedene Kernabstände wird die Schrödingergleichung sukzessiv gelöst. Man erhält schließlich einen Zusammenhang zwischen Bindungslänge und der Energie des Moleküls. Dies wird durch die Potenzialkurve ausgedrückt. Aus der Potenzialkurve lassen sich der Gleichgewichtsabstand und die Dissoziationsenergie der Bindung ermitteln.
Güte
Die Born-Oppenheimer-Näherung führt zu guten Ergebnissen für Moleküle im Grundzustand, insbesondere bei denen mit schweren Kernen. Allerdings kann sie zu sehr schlechten Ergebnissen für angeregte Moleküle und Kationen führen, was besonders bei der Photoelektronenspektroskopie zu beachten ist.
Quellen
- ↑ Max Born und J. Robert Oppenheimer: Zur Quantentheorie der Molekeln, Annalen der Physik, 389, Seiten 457-484 (1927)
- Ψel von den Kernpositionen
Wikimedia Foundation.
