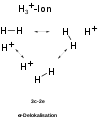
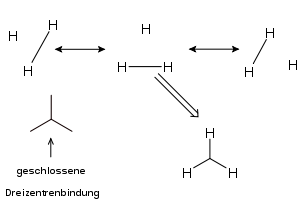
- Dreizentrenbindung
-
Die Dreizentrenbindung, die einfachste Mehrzentrenbindung, ist ein spezieller Typ der Atombindung (kovalente Bindung), bei der sich nicht zwei Atome, sondern drei Atome ein Elektronenpaar teilen. Nach der modernen Atomtheorie (Orbitaltheorie) beschreibt man Dreizentrenbindungen durch Überlappung dreier Atomorbitale, wobei drei Molekülorbitale entstehen. Hiervon ist eines stets bindend und eines antibindend. Das dritte Molekülorbital kann schwach bindenden, schwach antibindenden oder nichtbindenden Charakter besitzen. Paradebeispiele für Dreizentrenbindungen finden sich im H3+-Ion, im Diboran (B2H6), im Hydrogendifluorid-Ion (FHF−) oder im Nitrit-Ion (NO2−). Man spricht im Zusammenhang mit Drei- oder Mehrzentrenbindungen auch von einer Delokalisation der Bindungselektronen. Zweizentrenbindungen – die normalen kovalenten Bindungen – sowie freie Elektronenpaare werden dahingegen als lokalisiert bezeichnet.
Offene und geschlossene Dreizentrenbindungen
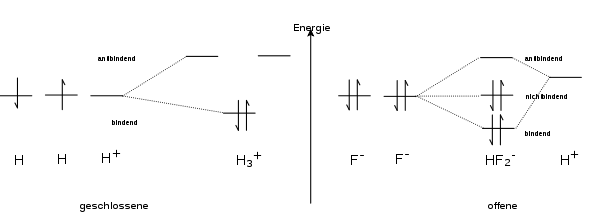
Man unterscheidet zwischen offenen Dreizentrenbindungen – wie man sie im FHF−-Ion findet – und geschlossenen Dreizentrenbindungen wie diejenige, die beim H3+-Ion vorliegt. Im ersten Fall zeigen zwei der drei Atome keine nennenswerte Orbitalüberlappung (hier die beiden Fluoratome), im zweiten Fall findet man eine paarweise Überlappung aller drei Atomorbitale – es bildet sich ein Ring aus. Durch zunehmende Abwinkelung kann eine offene in eine geschlossene Dreizentrenbindung übergehen. Während offene Dreizentrenbindungen bis zu vier Elektronen enthalten können – bis zu zwei davon findet man in einem nichtbindenden Orbital – ist eine geschlossene Dreizentrenbindung nur stabil, wenn höchstens zwei Elektronen in den Molekülorbitalen untergebracht werden.
3-Zentren-2-Elektronen-Bindung und 3-Zentren-4-Elektronen-Bindung
Man findet in der Literatur häufig die Begriffe 3-Zentren-2-Elektronen-Bindung (3c-2e) oder 3-Zentren-4-Elektronen-Bindung (3c-4e). Diese Begriffe geben an, wie viele Elektronen bei einem gegebenen Molekül in den drei Molekülorbitalen, die aus der Dreizentren-Wechselwirkung resultieren, untergebracht worden sind. Da aber nur eines der drei Molekülorbitale als signifikant bindend angesehen werden kann und maximal zwei Elektronen in diesem Orbital untergebracht werden können, wird nur der Begriff 3-Zentren-2-Elektronen-Bindung durchgängig benutzt. Bei vier Elektronen wird auch das nichtbindende Orbital doppelt besetzt. Da dieses Orbital nur an den beiden äußeren Atomen wesentliche Beiträge (Koeffizienten) besitzt, "ähneln" diese Elektronen freien Elektronenpaaren an diesen Atomen. Die Bindungsverhältnisse in diesen 3-Zentren-4-Elektronen-Bindung lassen sich dementsprechend über zwei mesomere Grenzstrukturen formulieren. Hierin sitzt an je einem der beiden äußeren Atome ein freies Elektronenpaar, das in Richtung des zentralen Atoms zeigt, während von dem anderen eine Bindung zum Zentralatom formuliert wird (bond/no-bond-Grenzstruktur)(siehe HF2−-Ion).
Symbole
Zur adäquaten Darstellung einer Dreizentrenbindung mit Lewis-Formeln braucht man mindestens zwei mesomere Grenzstrukturen. Daneben haben sich spezielle Symbole eingebürgert, die aber nicht durchgängig benutzt und akzeptiert werden, da sie teilweise mit der Skelettformel zu verwechseln sind.

Wikimedia Foundation.