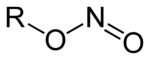- Nitrit
-
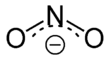 Nitrit-Anion
Nitrit-AnionNitrite sind die Salze (M+NO2-, M: einwertiges Kation) und Ester (R–O–N=O, R: organischer Rest) der Salpetrigen Säure HNO2. Von den Estern der Salpetrigen Säure sind die isomeren Nitroverbindungen (R-NO2) abzugrenzen, bei denen der organische Rest direkt am Stickstoff gebunden ist.
Inhaltsverzeichnis
Beispiele
Salze der Salpetrigen Säure Name Formel andere Bezeichnung Kaliumnitrit KNO2 E 249 Natriumnitrit NaNO2 E 250 Weitere Beispiele siehe Kategorie:Nitrit Ester der Salpetrigen Säure Name Formel Amylnitrit 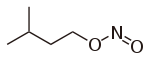
Weitere Beispiele siehe Kategorie:Ester Struktur
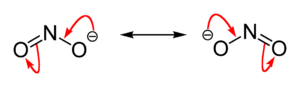
Das Nitrition hat eine gewinkelte Struktur mit einem Bindungswinkel von 115°. Die beiden mesomeren Grenzstrukturen zeigt die Abbildung:
Vorkommen
Nitritionen werden im Boden, in Gewässern und in Kläranlagen von Nitritbakterien (Nitrosomonas) durch Oxidation aus Ammoniumionen unter Verbrauch von Sauerstoff gebildet. Sie sind das Zwischenprodukt bei der vollständigen Oxidation des Stickstoffs zu Nitrat (Nitrifikation). Sie entstehen auch unter anaeroben Bedingungen durch bakterielle Reduktion aus Nitrat-Ionen (Nitratreduktion).
Verwendung
Als Lebensmittelzusatzstoffe dürfen Nitrite in Form von Kalium- (E 249) und Natriumnitrit (E 250) als Farbstabilisatoren im Nitritpökelsalz verwendet werden. Bei der Wurstproduktion ist die Verwendung von Nitriten vorgeschrieben, da es die Entwicklung des hochgefährlichen Botulismus-Bakteriums Clostridium botulinum verhindert.
Bei höheren Temperaturen können zusammen mit Eiweißbestandteilen der Nahrung Nitrosamine gebildet werden, die als kanzerogen (krebserregend) gelten. Daher sollten gepökelte Fleischwaren nie gegrillt werden.
Giftigkeit
Nitrite sind toxisch. Das Nitrition reagiert mit den Eisenatomen in eisenhaltigen Enzymen der Zellatmung sowie des Hämoglobins. Letzteres wird durch Nitrit zu Methämoglobin oxidiert (siehe auch Methämoglobinämie), wodurch die Fähigkeit zum Sauerstofftransport verlorengeht. Ferner sind Nitrite an der Bildung kanzerogener Nitrosamine beteiligt.
Auch für Fische ist Nitrit giftig, wobei eine starke Abhängigkeit vom pH-Wert des Wassers besteht, da nur die Salpetrige Säure durch die Kiemen in den Körper gelangen kann. Die LD50 (akute Giftigkeit) für Salpetrige Säure liegt für alle Fischarten übereinstimmend um 0,01 mg/l. Einen weiteren Weg in den Fisch finden Nitrit-Ionen durch einen aktiven Transportmechanismus, der eigentlich der Aufnahme von Chloridionen dient, wenn deren Konzentration im Wasser deutlich unter ca. 15 mg/l liegt.
Organische Nitrite wirken im Körper als Stickstoffmonoxid-Donatoren und verfügen dadurch über dessen Wirkung, die über einen second-messenger-Mechanismus eine Entspannung der glatten Muskulatur und eine Vasodilatation herbeiführen. Bei Überdosierung auch therapeutisch genutzter Nitrite kann es zu starkem Abfall des Blutdrucks, Kreislaufkollaps bis hin zum Schock kommen. Nitrite haben aber auch einen anderen Aspekt. Der Wirkung eines Aphrodisiakums kommen bestimmte Nitrite wie Isobutylnitrit und Amylnitrit am nächsten. Unter dem Namen Poppers sind sie seit vielen Jahrzehnten in Gebrauch. Sie steigern bei Inhalation die sexuelle Lust, die Wahrnehmung fokussiert auf ausschließlich anregende sexuelle Merkmale und die Dauer bis zum Höhepunkt wird für den Konsumenten lustvoll verlängert. Nitrite wirken in dieser Form auf Frauen und Männer gleich. Eine Gesundheitsgefährdung konnte bisher nicht nachhaltig belegt werden. In neuerer Zeit konzentrieren sich Studien darauf zu untersuchen, ob inhalierbare organische Nitrite immunsuppressive oder cancerogene Eigenschaften besitzen und so ganz allgemein zum Wachstum von Tumoren beitragen können[1].
Nachweis
Nitrit lässt sich mittels einer Farbreaktion nachweisen. Dazu säuert man die entsprechende Substanz mit verdünnter Essigsäure an und versetzt sie mit wenig Lunges Reagenz (Lösungen von Sulfanilsäure und α-Naphthylamin). Eine Pinkfärbung durch einen Azofarbstoff zeigt Nitrit an.
Diese Farbbildung wird in weiterentwickelter Form auch durch photometrische Messung zur quantitativen Bestimmung von Nitrit z. B. in Wasser verwendet. Sie ist in der DIN EN 26 777 (bis 1993: DIN 38 405 D10) normiert.
Alternativ dazu wird häufig die so genannte Griess-Reaktion, die ebenfalls über eine Azofärbung zum Nitirit-Nachweis funktioniert, verwendet.
Quellen
- ↑ Tran DC. et al. (2005): Effects of repeated in vivo inhalant nitrite exposure on gene expression in mouse liver and lungs. Nitric Oxide. 14(4): 279-89. PMID 16288974
Siehe auch
Weblinks
Wikimedia Foundation.