- Elektronegativitätsdifferenz
-
Die Elektronegativitätsdifferenz (im Laborjargon auch Delta-EN (ΔEN) genannt) ist in einer Bindung die Differenz der Elektronegativitäten der beteiligten Atome.
Die gemeinsamen Elektronen werden vom Bindungspartner mit der größeren Elektronegativität stärker angezogen und führen an ihm zu einer negativen Teilladung. Umgekehrt entsteht am Bindungspartner mit der kleineren Elektronegativität eine positive Teilladung. Womit eine polare Elektronenbindung ausgebildet wird.
Wird Delta-EN sehr groß, so kann die Bindung häufig vorteilhafter als Ionenbindung (elektrovalente Bindung) beschrieben werden. Substanzen, in denen der elektrovalente Anteil der Bindung dominiert, werden Salze genannt. Allerdings ist Delta-EN nicht das einzige Kriterium für das Vorliegen eines Salzes, wie leicht am Beispiel der Verbindungen Lithiumiodid (LiI) und Fluorwasserstoff (HF) gezeigt werden kann. Obwohl Delta-EN für HF mit 1,9 größer ist als der Wert von 1,2 für LiI, ist Fluorwasserstoff eine Molekülverbindung, während Lithiumiodid ein Salz mit typischem polymeren Aufbau (Kochsalz-Struktur) ist.
Fluorwasserstoff (HF) Kohlenstoffdioxid (CO2) Wasser (H2O) 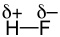
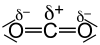
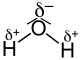
ΔEN = 1,9 ΔEN = 1,0 ΔEN = 1,4 Als Faustregel kann gesagt werden, dass Moleküle mit einem asymmetrischen Aufbau und einer Differenz der Elektronegativitäten (ΔEN) nach Pauling kleiner 1,7 aber größer als 0,5 als Dipol-Moleküle erscheinen, d. h. sie sind zwar nach außen elektrisch neutral, haben aber ein (messbares) Dipolmoment. Bei ΔEN größer 1,7 nimmt man ionischen Bindungscharakter an. Allerdings ist die Grenze ΔEN < 1,7 als Richtwert anzusehen wie sich an den Beispielen Fluorwasserstoff und Aluminiumchlorid (ΔEN = 1,5) zeigt. Bei ΔEN kleiner 0,5 nimmt man unpolare Moleküle an.
Die Verbindungen, die als theoretisches Ion das H+ (Proton) besitzen, können keine Ionenverbindungen sein, da das H+ aufgrund vollständig fehlender Elektronenhülle kein echtes selbständiges Ion ist. Mit H+ bildet sich deshalb grundsätzlich das s-p-σ- bzw. s-q-σ-Bindungsorbital, aus dem das H+ in einer Protolysereaktion bei ausreichendem ΔEN herauswechseln kann.
Wikimedia Foundation.

