- Wassermolekül
-
Dieser Artikel wurde aufgrund von Mängeln auf der Qualitätssicherung der Redaktion Naturwissenschaft und Technik eingetragen. Dies geschieht, um die Qualität der Artikel aus den übergreifenden Themengebieten der Naturwissenschaften auf ein akzeptables Niveau zu bringen. Dabei können Artikel gelöscht werden, die nicht signifikant verbessert werden können. Hilf mit, die Mängel dieses Artikels zu beseitigen, und beteilige dich an der Diskussion. Das Molekül des Wassers besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom. Es ist die Grundlage zur Erklärung der Eigenschaften des Wassers.
Inhaltsverzeichnis
Geometrie
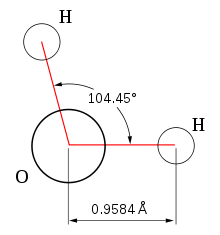
Geometrisch ist das Wassermolekül gewinkelt und entspricht nach dem VSEPR-Modell einem AB2E2-Typ. Die zwei Wasserstoffatome und die zwei freien Elektronenpaare sind folglich in die Ecken eines gedachten Tetraeders gerichtet. Der Winkel, den die beiden O-H-Bindungen einschließen, beträgt 104,45°. Er weicht aufgrund des erhöhten Platzbedarfs der freien Elektronenpaare vom idealen Tetraederwinkel (~109,47°) ab. Die Bindungslänge der O-H-Bindungen beträgt jeweils 95,84 Pikometer.
Im Wassermolekül verbinden sich die 1s-Orbitale von zwei Wasserstoffatomen mit je einem sp3-Hybridorbital des Sauerstoff-Atoms zu zwei σ-Bindungen. Die vier Orbitale der bindenden und nichtbindenden Elektronenpaare sind nach den Ecken eines Tetraeders ausgerichtet. Die freien Elektronenpaare befinden sich in den Atomorbitalen und die Elektronenpaare zur O-H-Bindung in den Molekülorbitalen.
Dipolmoment
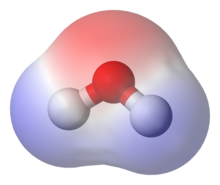
Sauerstoff hat in der Pauling-Skala mit 3,5 eine um 1,4 höhere Elektronegativität als Wasserstoff mit 2,1. Durch die gewinkelte Geometrie des Moleküls und die unterschiedlichen Partialladungen der Atome hat es auf der Seite des Sauerstoffs negative und auf der Seite der beiden Wasserstoffatome positive Polarität. Diese bewirkt das Dipolmoment, das in der Gasphase 1,84 Debye beträgt. Im Unterschied zum linear aufgebauten Kohlenstoffdioxid zeigt sich dabei, dass die winklige Anordnung der beiden Wasserstoffatome einen gegenseitigen Ausgleich der polaren Atombindungen verhindert, die Ladungsschwerpunkte also nicht zusammen fallen. Erst hierdurch besitzt Wasser ein permanentes elektrisches Dipolmoment und weist viele hierdurch bedingte Eigenschaften auf. Eine Erklärung für diese winklige Anordnung liefert die VSEPR-Theorie anhand der beiden einsamen Elektronenpaare des Sauerstoffatoms. Durch die unterschiedlichen Partialladungen kann das Molekül von bestimmten elektromagnetischen Wellen, den Mikrowellen, in Rotationen versetzt werden, welche zur Erwärmung des Wassers führen.
Wasserstoffbrückenbindung
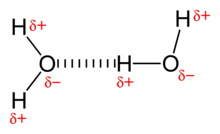
Wassermoleküle wechselwirken miteinander über Wasserstoffbrückenbindungen und besitzen dadurch ausgeprägte zwischenmolekulare Anziehungskräfte. Es handelt sich dabei um keine beständige, feste Verkettung. Der Verbund der über Wasserstoffbrückenbindungen unbeständig verketteten Wassermoleküle besteht nur Bruchteile von Sekunden, wonach sich die einzelnen Moleküle wieder aus dem Verbund lösen und sich in einem ebenso kurzen Zeitraum erneut verketten. Dieser Vorgang wiederholt sich ständig und führt letztendlich zur Ausbildung eines variablen Clusters, wie in der rechten Abbildung skizzenhaft dargestellt (Wassercluster).
Für die Ausbildung der Wasserstoffbrückenbindungen ist unter anderem der kleine Durchmesser des Wasserstoffatoms von Bedeutung, da es sich nur so in ausreichendem Maße dem Sauerstoffatom nähern kann. Die höheren Homologen des Wasser, zum Beispiel Schwefelwasserstoff H2S, bilden derartige Bindungen aufgrund der geringeren Elektronegativitätsdifferenz zwischen den Bindungspartnern nicht aus.
Die Verkettung der Wassermoleküle durch Wasserstoffbrückenbindungen ist die Ursache für viele besondere Eigenschaften, zum Beispiel dafür, dass Wasser trotz der geringen molaren Masse von rund 18 g/mol unter Standardbedingungen flüssig ist. H2S liegt im Gegensatz dazu gasförmig vor. Auch, dass Wasser aufgrund seiner Dichteanomalie die größte Dichte bei rund vier Grad Celsius aufweist und somit beispielsweise Eis auf flüssigem Wasser schwimmen kann, ist auf die Wasserstoffbrückenbindungen zurückzuführen.
Schweres, halbschweres und überschweres Wasser
Neben dem „normalen“ Wasser gibt es noch das „schwere Wasser“ (Deuteriumoxid, D2O), das „halbschwere Wasser“ (HDO) und das „überschwere Wasser“ (Tritiumoxid, T2O). Bei diesen Wässern sind die normalen Wasserstoffatome (Protium, Symbol H) teilweise oder ganz durch ihre schwereren Isotope Deuterium (D) oder Tritium (T) ersetzt. Schwere Wasser unterscheiden sich bezüglich ihrer physikalischen wie chemischen Eigenschaften von gewöhnlichem Wasser. Sie besitzen einen höheren Schmelzpunkt, einen höheren Siedepunkt und eine größere Dichte. Aufgrund des besonders großen Massenunterschieds zwischen Protium und Tritium bzw. Deuterium ist hier der kinetische Isotopeneffekt besonders ausgeprägt. Folglich wird bei Ersatz des normalen Wassers mit schwererem Wasser bei chemischen Gleichgewichtsreaktionen die Gleichgewichtslage verändert, was zum Beispiel im menschlichen Körper zu gesundheitlichen Folgen führen kann.
Deuteriertes Wasser wird aufgrund der anderen Spineigenschaften des Kernspins als Lösungsmittel für NMR-Analytik benutzt. Die Wasserstoffisotope des Wassermoleküls werden zusammen mit dem Sauerstoffisotop 18O als Tracer verwandt.
Weblinks
Wikimedia Foundation.