- Eszopiclon
-
Strukturformel 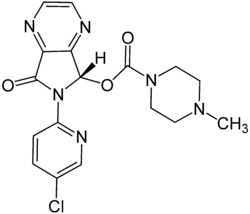
Allgemeines Freiname Eszopiclon Andere Namen - (S)-6-(5-Chlor-2-pyridyl)- 6,7-dihydro-7-oxo-5H-pyrrolo[3,4-b]pyrazin- 5-yl-4-methyl-1-piperazincarboxylat
- Latein: Eszopiclonum
Summenformel C17H17ClN6O3 CAS-Nummer 138729-47-2 PubChem 969472 ATC-Code N05CF04
DrugBank DB00402 Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: Ja Eigenschaften Molare Masse 388,81 g·mol−1 Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] Keine Einstufung verfügbarR- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Eszopiclon ist ein Arzneistoff aus der Gruppe der Schlafmittel und in der Wirkung den Benzodiazepinen verwandt.
Chemisch gehört die Substanz zur Klasse der Cyclopyrrolone. Von den beiden Enantiomeren (R)- und (S)-Zopiclon wirkt ausschließlich das (S)-Enantiomer Eszopiclon schlafanstoßend. Durch die Verwendung von Eszopiclon kann die Dosis deutlich gesenkt werden gegenüber der Anwendung des racemischen Gemischs. Eszopiclon ist seit 2005 in den USA als Schlafmittel zugelassen und dort unter dem Markennamen Lunesta erhältlich.[2] Einen Zulassungsantrag in der EU hatte der Hersteller zurückgezogen, nach dem der Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur das Arzneimittel zwar zulassen wollte, für das enthaltene Eszopiclon jedoch den Status einer "neuen Wirksubstanz" verweigerte.[3][4] Dadurch hätte der Hersteller, die Firma Sepracor Pharmaceuticals, nicht von der zehnjährigen Marktexklusivität profitieren können, die Arzneimitteln mit neuen Arzneistoffen zugestanden wird.
Einzelnachweise
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ FDA approved labeling text for LUNESTA® (eszopiclone) 2009.
- ↑ EMEA-Pressemeldung zum Zulassungsantrag Lunivia 19. Mai 2009 (englisch).
- ↑ [http://www.emea.europa.eu/humandocs/PDFs/EPAR/lunivia/H-895-WQ&A-de.pdf Fragen und Antworten zur Rücknahme des Zulassungsantrages für Lunivia], 29. Mai 2009. (Link nicht mehr abrufbar)

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-N05
- Arzneistoff
- Hypnotikum
- Carbamat
- Chloraromat
- Pyridin
- Pyrrolin
- Pyrazin
- Lactam
- Piperazin
Wikimedia Foundation.
