- Exotherme Reaktion
-
Als exotherm bezeichnet man in der Chemie einen Vorgang, meist eine chemische Reaktion, bei dem Energie in Form von Wärme an die Umgebung abgegeben wird. Den Gegensatz dazu bildet die endotherme Reaktion. Bei einer exothermen Reaktion ist die so genannte Reaktionsenthalpie ΔRH negativ.[1] Die Enthalpie H ist die Summe aus der inneren Energie eines Systems und dem Produkt aus Druck und Volumen. Sie ist der Wärmegehalt eines Systems bei konstantem Druck.[2][3]
Der Begriff exotherm ist nicht mit dem Begriff exergon zu verwechseln (siehe: Abgrenzung!).
Inhaltsverzeichnis
Typische exotherme Reaktionen sind:- Feuer (Verbrennung) sowie
- Abbinden (= Aushärten) von Beton.
Exotherm, wenn auch in weit geringerem Maße, verläuft oft auch das Mischen von Stoffen (Mischungswärme) oder die Adsorption und Absorption von Stoffen etwa an Aktivkohle oder Zeolithen.
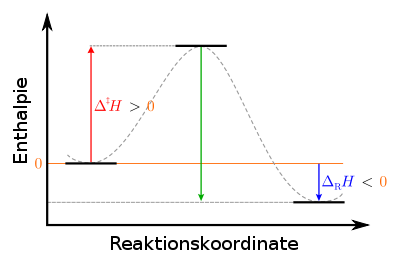
Bezeichnet ΔH die Differenz der Enthalpien der End- (H2) und Ausgangsstoffe (H1), also die aufgenommene Energie, gilt für exotherme Reaktionen ΔH = H2 − H1 < 0.
Auch in der Physik bezeichnet man eine Kernreaktion, bei der Energie frei wird, als exotherm. Eine exotherme Kernfusion ist etwa das Wasserstoffbrennen, wie es in der Sonne geschieht.
Ablauf
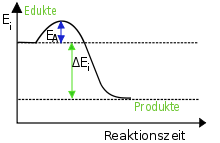
Die Edukte befinden sich zunächst in einem metastabilen Zustand. Durch kurze Zufuhr eines bestimmten Energiebetrags, der Aktivierungsenergie (Aktivierungsenthalpie), wird das System in den instabilen Zustand gehoben. Durch die Aktivierung kommt die Reaktion in Gang und läuft ohne weitere Energiezufuhr selbständig ab. In der Gesamtbilanz gibt das chemische System Energie an die Umgebung ab, sie wird als Reaktionsenthalpie bezeichnet. Die Produkte befinden sich jetzt in einem stabilen Zustand. Zur Stabilität von Systemen siehe auch Systemeigenschaften.
Ein Beispiel für das Hinzufügen der Aktivierungsenergie ist das Entzünden von Feuer durch das Reiben eines Steichholzes an der Reibfläche oder, bei Gasen, mit einem elektrischen Funken.
Legende:



links: Ausgangszustand der Edukte: metastabil
mittig: Übergangszustand des aktivierten Komplexes: instabil
rechts: Endzustand der Produkte: stabilBeispiel: Kohlenstoff verbrennt mit dem Sauerstoff der Luft unter Wärmeentwicklung zu Kohlenstoffdioxid:
 .
.Die Reaktionsenthalpie (Enthalpiedifferenz) ΔH dieser Reaktion ist negativ. Sie lässt sich aus den Standardbildungsenthalpien berechnen.
Ist die Aktivierungsenergie sehr niedrig, kann die Reaktion bereits ohne zusätzliche Energiezufuhr von außen in Gang gesetzt werden. Die notwendige Aktivierungsenergie wird der Umgebung entzogen. Die Reaktion läuft exergon (spontan) ab.
Abgrenzung
Wenn man von einem exothermen Vorgang spricht, wird keine Aussage darüber getroffen, ob eine Reaktion freiwillig abläuft. Hier unterscheidet man dann zwischen exergonen und endergonen Reaktionen.
Einzelnachweise
- ↑ PAC, 1996, 68, 149 (A glossary of terms used in chemical kinetics, including reaction dynamics [IUPAC Recommendations, 1996]), Seite 165.
- ↑ PAC, 1996, 68, 957 (Glossary of terms in quantities and units in Clinical Chemistry [IUPAC-IFCC Recommendations, 1996]), Seite 972.
- ↑ PAC, 1990, 62, 2167 (Glossary of atmospheric chemistry terms [Recommendations, 1990]), Seite 2187.
Wikimedia Foundation.