- Endotherme Reaktion
-
Als endotherm werden in der Chemie Reaktionen bezeichnet, deren Standardenthalpiedifferenz
 positiv ist.[1] Die Enthalpie H ist die Summe aus der Inneren Energie eines Systems und dem Produkt aus Druck und Volumen. Sie ist der Wärmegehalt eines Systems bei konstantem Druck.[2] Eine endotherme Reaktion ist demnach eine Reaktion, bei der Energie in Form von Wärme aus der Umgebung aufgenommen wird. Sie stellt das Gegenteil einer exothermen Reaktion dar. Bezeichnet ΔH die Differenz der Enthalpien der End- (H2) und Ausgangsstoffe (H1), also die aufgenommene Energie, gilt für endotherme Reaktionen: ΔH = H2 − H1 > 0.
positiv ist.[1] Die Enthalpie H ist die Summe aus der Inneren Energie eines Systems und dem Produkt aus Druck und Volumen. Sie ist der Wärmegehalt eines Systems bei konstantem Druck.[2] Eine endotherme Reaktion ist demnach eine Reaktion, bei der Energie in Form von Wärme aus der Umgebung aufgenommen wird. Sie stellt das Gegenteil einer exothermen Reaktion dar. Bezeichnet ΔH die Differenz der Enthalpien der End- (H2) und Ausgangsstoffe (H1), also die aufgenommene Energie, gilt für endotherme Reaktionen: ΔH = H2 − H1 > 0.Inhaltsverzeichnis
Ablauf einer endothermen Reaktion
Wie bei exothermen Reaktionen erfolgt auch bei endothermen Reaktionen der Ablauf in zwei Schritten. Zunächst muss eine bestimmte Aktivierungsenergie aufgebracht werden, anschließend wird ein Teil dieser Energie wieder frei. Der Unterschied zur exothermen Reaktion liegt darin, dass diese freiwerdende Energie geringer als die Aktivierungsenergie ist und daher nicht ausreicht, die Reaktion weiter voranzutreiben. Die Reaktionsenergie ist positiv. Daher muss, um die Reaktion nicht zu unterbrechen, während der Reaktion Energie kontinuierlich von außen zugeführt werden.
Damit eine endotherme Reaktion überhaupt stattfinden kann (exergon ist), muss die Reaktion durch Zunahme der Entropie begünstigt sein und so eine negative freie Enthalpie besitzen. Endotherme Reaktionen finden daher häufig bei hohen Temperaturen statt, da bei diesen gemäß der Gibbs-Helmholtz-Gleichung der Entropieanteil der freien Enthalpie größer ist. Dies zeigt sich beispielsweise am Boudouard-Gleichgewicht, bei dem bei hohen Temperaturen die endotherme Reaktion zu Kohlenstoffmonoxid stattfindet.
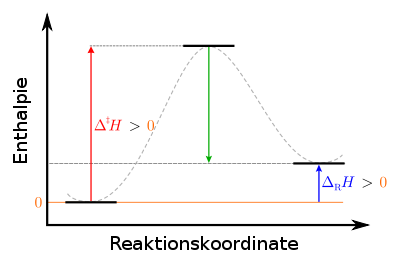
Legende:



links: Ausgangszustand der Edukte: stabil
mittig: Übergangszustand des aktivierten Komplexes: instabil
rechts: Endzustand der Produkte: metastabilBeispielsweise: Führt man einer Koksschicht Wasserdampf zu, findet eine endotherme Reaktion statt:
 .
.Industrielle Chemie
Als allotherm werden endotherme Reaktionen in der industriellen Chemie bezeichnet.[3] Wichtige Beispiele hierfür sind etwa allotherme Pyrolysen, bei denen die Biomasse durch von außen zugeführte Wärme gespalten wird oder die Dampfreformierung bei der Herstellung von Synthesegas. Der Gegensatz dazu sind im industriellen Sprachgebrauch autotherme Reaktionen.
Physik
In der Physik heißt dementsprechend eine Kernreaktion endotherm, wenn sie nur mit äußerer Energiezufuhr stattfinden kann. Die Energie muss als kinetische Energie der anfänglichen Reaktionspartner vorhanden sein.
Weblinks
 Wikibooks: Anorganische Chemie für Schüler/ Metalle und Redoxreaktionen & Energiediagramm – Lern- und Lehrmaterialien
Wikibooks: Anorganische Chemie für Schüler/ Metalle und Redoxreaktionen & Energiediagramm – Lern- und LehrmaterialienEinzelnachweise
- ↑ IUPAC: Goldbook: endothermic reaction
- ↑ IUPAC: Goldbook: enthalpy, H
- ↑ K. Weissermel, H.-J. Arpe: Industrielle organische Chemie: Bedeutende vor- und Zwischenprodukte. Wiley-VCH, 2007, ISBN 978-3-527-31540-6
Wikimedia Foundation.
