- F11R
-
Die Junctional Adhesion Molecules („junktionales Adhäsionsmolekül“[1], lat. iunction = „Verbindung“) (JAM) sind eine Familie von Genen, deren Genprodukte als integrale Membranproteine eine wichtige Rolle bei der Verknüfung von Zellen, insbesondere Endothelzellen, spielt. Sie gehören zur Immunoglobulin-Superfamilie.[2]
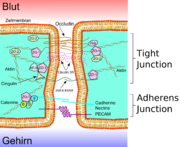
Die Junctional Adhesion Molecules sind Bestandteil der Tight Junctions und werden im wesentlichen auf Epithelien und Endothelien, aber auch auf Leukozyten, Thrombozyten und anderen Zelltypen, exprimiert.[3]. Sie besitzen nur eine transmembrane Domäne. Der N-Terminus ist im extrazellulären Raum. Dort bilden die JAMs Cystein-Brücken aus.[4] Innerhalb des Zytoplasmas sind die JAMs mit dem Aktin-Zytoskelett verbunden.
Inhaltsverzeichnis
Familienmitglieder
Bisher sind drei Junctional Adhesion Molecules bekannt.
JAM1
Befindet sich beim Menschen auf Chromosom 1 Genlocus q21.2-q21.3.. Die Bezeichnung JAM1 ist, ebenso wie PAM-1, JCAM, JAMA oder CD321 veraltet. Das Gen wird nun als F11R bezeichnet. JAM1 war das erste Junctional Adhesion Molecule das entdeckt wurde. F11R wird im wesentlichen in den Tight Junctions epithelialer und endothelialer Zellen exprimiert. Es spielt bei der Migration von Leukozyten eine Schlüsselrolle. Ebenso ist es in die durch Antikörper induzierte Thrombozytenaggregation involviert.[5]
JAM2
JAM2 (alias: VE-JAM, JAMB oder CD322) befindet sich beim Menschen auf Chromosom 21 Genlocus q21.2. Es spielt bei der Transmigration von Lymphozyten durch das Endothel eine wichtige Rolle.[6] JAM2 wurde erstmals 2001 beschrieben und wird auf Endothelien und Lymphatischen Zellen exprimiert. Es besteht aus 310 Aminosäuren und hat eine molare Masse von 45 kDa.[7]
JAM3
Das Dritte bisher bekannte Junctional Adhesion Molecule ist JAM3 oder auch JAMC genannt. Das für dieses Protein kodierende Gen befindet sich beim Menschen auf Chromosom 11 Genlocus q25. JAM3 wird außer in Endothel- und Epithelzellen auch in Fibroblasten,[8] Zellen der glatten Muskulatur, [9] Spermatiden[10] und peripheren Nervenzellen[11] exprimiert.
Literatur
- A. Preator u. a.: Genetic deletion of JAM-C reveals a role in myeloid progenitor generation. In: Blood 113, 2009, S. 1919–1928. PMID 19109565
- G. Ostermann: Identification of junctional adhesion molecule (JAM)-1 as a novel immunoglobulin superfamily ligand for lymphocyte function-associated antigen (LFA)-1. Dissertation, LMU München, 2002
Einzelnachweise und Fußnoten
- ↑ Anmerkung: Dieser Begriff ist in der deutschsprachigen Fachliteratur, im Gegensatz zu der englischsprachigen Bezeichnung, kaum gebräuchlich.
- ↑ K. J. Mandell und C. A. Parkos : The JAM family of proteins. In: Adv Drug Deliv Rev 57, 2005, S. 857–867. PMID 15820556
- ↑ G.Bazzoni: The JAM family of junctional adhesion molecules. In: Curr Opin Cell Biol 15, 2003, S. 525–530. PMID 14519386
- ↑ P. Florian: Restitution von Einzelzell-Läsionen im Kolonepithel. Dissertation, FU Berlin, 2002
- ↑ U. P. Naik und K. Eckfeld: Junctional adhesion molecule 1 (JAM-1). In: J Biol Regul Homeost Agents 17, 2003, S. 341–347. PMID 15065765 (Review)
- ↑ M. Aurrand-Lions u. a.: Junctional adhesion molecules and interendothelial junctions. In: Cells Tissues Organs 172, 2002, S. 152-160. PMID 12476045
- ↑ M. Aurrand-Lions u. a.: JAM-2, a novel immunoglobulin superfamily molecule, expressed by endothelial and lymphatic cells. In: J Biol Chem 276, 2001, S 2733–-2741. PMID 11053409
- ↑ A. P. Morris u. a.: Junctional Adhesion Molecules (JAMs) are differentially expressed in fibroblasts and co-localize with ZO-1 to adherens-like junctions. In: Cell Commun Adhes 13, 2006, S. 233–247. PMID 16916751
- ↑ T. Keiper u. a.: The role of junctional adhesion molecule-C (JAM-C) in oxidized LDL-mediated leukocyte recruitment. In: FASEB J 19, 2005, S. 2078–2080. PMID 16195363
- ↑ G. Gliki u. a.: Spermatid differentiation requires the assembly of a cell polarity complex downstream of junctional adhesion molecule-C. In: Nature 431, 2004, S. 320–324. PMID 15372036
- ↑ C. Scheiermann u. a.: Expression and function of junctional adhesion molecule-C in myelinated peripheral nerves. In: Science 318, 2007, S. 1472–1475. PMID 18048693
Wikimedia Foundation.