- GC-Gehalt
-
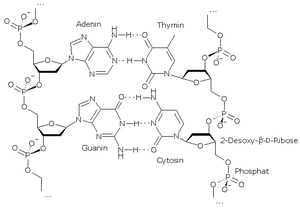
Der GC-Gehalt ist ein Merkmal von DNA-Molekülen und gibt den Anteil der DNA-Basen Guanin und Cytosin an der Gesamtheit der Basen (Guanin, Cytosin, Adenin und Thymin) in Prozent an.
 Modell einer DNA-Doppelhelix. Die beiden DNA-Stränge werden durch Wasserstoffbrücken zwischen den Basenpaaren im Inneren zusammengehalten.
Modell einer DNA-Doppelhelix. Die beiden DNA-Stränge werden durch Wasserstoffbrücken zwischen den Basenpaaren im Inneren zusammengehalten.
- Es gilt: GC-Gehalt [%] = (G+C)/(G+C+A+T) · 100
- Einem GC-Gehalt von beispielsweise 64% entspricht somit ein AT-Gehalt von 36%.
Inhaltsverzeichnis
GC-Gehalt und Stabilität der DNA-Doppelhelix
Die jeweils komplementären Basen A-T und G-C sind im doppelsträngigen DNA-Molekül über Wasserstoffbrücken miteinander verbunden. Die Adenin-Thymin-Paare bilden stets zwei Wasserstoffbrücken aus, Guanin-Cytosin-Paare drei. Anders als zunächst angenommen[1], ist der Energiegewinn durch Wasserstoffbrückenbindungen vernachlässigbar, da die Basen mit dem umgebenen Wasser ähnlich gute Wasserstoffbrückenbindungen eingehen können. Die Wasserstoffbrücken eines GC-Basenpaares tragen nur minimal zur Stabilität der Doppelhelix bei, während die Wasserstoffbrücken eines AT-Basenpaares sogar destabilisierend wirken[2]. Stapelwechselwirkungen (stacking interactions) hingegen wirken nur in der Doppelhelix zwischen aufeinanderfolgenden Basenpaaren: Zwischen den aromatischen Ringsystemen der heterozyklischen Basen entsteht eine dipol-induzierte Dipol-Wechselwirkung, welche energetisch günstig ist. Somit ist die Bildung des ersten Basenpaares auf Grund des geringen Energiegewinnes und des Entropieverlustes recht ungünstig, jedoch die Elongation (Verlängerung) der Helix ist energetisch günstig, da die Basenpaarstapelung unter Energiegewinn verläuft.
Die Stapelwechselwirkungen sind jedoch sequenzabhängig und sind energetisch am günstigsten für gestapelte GC-GC, während sie für gestapelte AT-AT weniger günstig sind. Die Unterschiede in den Stapelwechselwirkungen erklären hauptsächlich die Tatsache, dass GC-reiche DNA-Abschnitte thermodynamisch stabiler sind als AT-reiche Sequenzen, während Wasserstoffbrückenbildung eine untergeordnete Rolle spielt.[2]
Bestimmung des GC-Gehaltes
Der GC-Gehalt von DNA kann experimentell mit verschiedenen Methoden bestimmt werden. Der einfachste Weg ist, die sogenannte "Schmelztemperatur" der DNA-Doppelhelix mithilfe eines Photometers zu messen: DNA absorbiert ultraviolettes Licht einer Wellenlänge von 260 nm. Denaturiert ("schmilzt") der Doppelstrang beim Erhitzen in zwei Einzelstränge, steigt die Lichtabsorption um etwa 40 %. Diesen Effekt bezeichnet man als Hyperchromizität.
Die Schmelztemperatur Tm eines DNA-Doppelstranges ist direkt abhängig von dessen GC-Gehalt und definiert als die Temperatur, bei der 50 % der Doppelhelix in denaturiertem Zustand (also einzelsträngig) vorliegen. Aus der fotometrisch bestimmten Schmelztemperatur kann der GC-Gehalt mit der empirischen Formel (Tm – 69,4) x 2,44 errechnet werden[3].Wesentlich genauer ist die Bestimmung des GC-Gehaltes mithilfe der Gaschromatographie. Ist hingegen die Sequenz des DNA-Moleküls bekannt, kann der GC-Gehalt einfach mit der oben angegebenen Formel berechnet werden.
GC-Gehalt und Taxonomie
Der GC-Gehalt im Genom wird als taxonomisches Merkmal zur Einteilung der Organismen, insbesondere von Bakterien verwendet. Die Werte reichen hier von ca. 20 bis fast 80 %. Bakterien mit hohem GC-Gehalt findet man vor allem unter den Actinobacteria, aber auch Deltaproteobakterien wie Myxobakterien sind GC-reich. Thermophile Organismen weisen ebenfalls erhöhte GC-Gehalte auf, was sicher auf die größere Stabilität der G-C-Basenpaarung zurückzuführen ist.
GC-Gehalte einiger Modellorganismen:
Art Phylogenetische Gruppe GC-Gehalt Streptomyces coelicolor
Myxococcus xanthus
Halobacterium sp.
Saccharomyces cerevisiae (Bäckerhefe)
Arabidopsis thaliana (Ackerschmalwand)
Methanosphaera stadtmanae
Plasmodium falciparum (Malariaerreger)Actinobacterium
Deltaproteobakterium
Archaeon
Ascomycet (Pilz)
Blütenpflanze
Archaeon
Protozoon72 %
68 %
67 %
38 %
36 %
27 %
≈20 %Zum Vergleich: Der durchschnittliche GC-Gehalt beim Menschen beträgt 41 % (siehe dazu auch CpG-Insel). Aufgrund der Struktur des genetischen Codes ist es für einen Organismus praktisch unmöglich, sein Genom ausschließlich aus zwei Basen (G-C oder A-T) aufzubauen und damit einen GC-Gehalt von 100 % oder 0 % zu erreichen. Die Anzahl möglicher Codons reicht nicht aus, um alle Aminosäuren in einem Zwei-Basen-Code zu verschlüsseln.
GC-Gehalte einzelner DNA-Abschnitte
Der Anteil der Basenpaare GC und AT variiert aber auch innerhalb eines Genoms.
AT-reiche (und daher GC-arme) Regionen findet man im Genom häufig an den Stellen, an denen die Doppelhelix leicht auflösbar sein muss, zum Beispiel an den Punkten, an denen die Replikation des DNA-Moleküls beginnt. Auch in menschlichen Chromosomen existieren Regionen mit GC-Gehalten, die deutlich von 50% abweichen. Diese Abschnitte sind meist in die Aufrechterhaltung der räumlichen Struktur der Chromosomen einbezogen.
Außerdem ist der GC-Gehalt in den DNA-Abschnitten, die für ein Gen codieren oft höher, als in anderen Regionen (zum Beispiel Introns, regulatorische Sequenzen). Diese Eigenschaft nutzt man aus, um in sequenzierten Genomen nach den eigentlichen Genen zu suchen: Genomsequenzen bestehen zunächst ausschließlich aus einer Abfolge von Millionen Basen. Die Annotation der eigentlichen Gene (das heißt, deren Start- und Endpunkt im Genom) erfolgt mit Hilfe von Computerprogrammen (z.B. GLIMMER), die GC-reiche Abschnitte finden und als mögliche Gene identifizieren.
Stößt man beim Studium eines Organismus auf funktionelle Gene, deren GC-Gehalt deutlich von dem der übrigen Gene abweicht, wird dies häufig als Hinweis darauf gewertet, dass diese Gene erst kürzlich durch horizontalen Gentransfer erworben wurden oder von einem Retrovirus stammen.Einzelnachweise
- ↑ Watson, J.D. & Crick F.H. (1953): Molecular structure of nucleic acids. A structure for deoxyribose nucleic acid. In: Nature. Bd. 171, Nr. 4356, S. 737–738. PMID 13054692, http://www.nature.com/nature/dna50/watsoncrick.pdf
- ↑ a b Peter Yakovchuk, Ekaterina Protozanova and Maxim D. Frank-Kamenetskii. Base-stacking and base-pairing contributions into thermal stability of the DNA double helix. Nucleic Acids Research 2006 34(2):564-574; doi:10.1093/nar/gkj454 PMID 16449200
- ↑ De Ley J.: Reexamination of the Association Between Melting Point, Buoyant Density, and Chemical Base Composition of Deoxyribonucleic Acid In: J. Bact. 101 (3), 738 – 754 (1970)
Siehe auch
Wikimedia Foundation.