- Heckreaktion
-
Die Heck-Reaktion zählt zu den bestuntersuchten metallorganischen Reaktionen und findet breite Anwendung in der organischen Synthese. Bei ihr handelt es sich um eine Palladium-katalysierte Kreuzkupplung. Sie ermöglicht die direkte Olefinierung von Arylhalogeniden, wobei das Halogenid durch die entsprechende Alkenylgruppe ersetzt wird. Es können einfache Alkene, arylsubstituierte Alkene oder elektrophile Alkene wie Acrylester eingesetzt werden. Die Heck-Reaktion ist mit der Suzuki-Kupplung verwandt und entsprechend mechanistisch ähnlich.
Benannt ist die Reaktion nach dem amerikanischen Chemiker Richard F. Heck.
Mechanismus
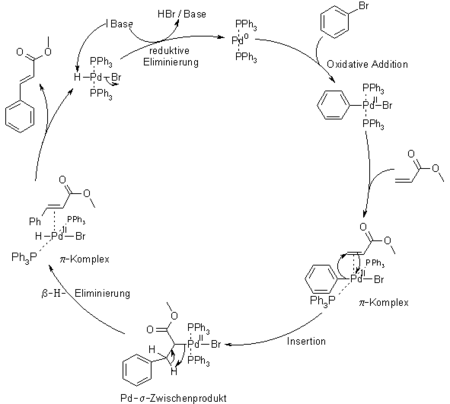
Der Katalysezyklus beginnt mit der oxidativen Addition des Halogenids an die Palladium(0)-Spezies, wobei formal ein Palladium(II)-Komplex gebildet wird, der dann in die Alkenkomponente insertiert. Aus der Pd(II)-Zwischenstufe wird zunächst das Alken unter β-Hydrid-Eliminierung abgespalten, dann wird durch eine reduktive Eliminierung von HX Pd(0) zurück gebildet. Das freigesetzte HX wird durch die Base gebunden.
Bei der Heck-Reaktion wird selektiv die trans-substituierte Doppelbindung erhalten. Der Grund hierfür ist, dass zunächst eine syn-Addition abläuft, die abschließende β-Hydrid-Eliminierung allerdings wiederum syn verläuft. Aus diesem Grund muss zwischenzeitlich eine Rotation um die C-C-Einfachbindung ablaufen und man erhält letztendlich das trans-Produkt.
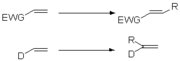
Je nachdem ob die Doppelbindung des eingesetzten Olefins Akzeptor- (EWG) oder Donor-substituiert (D) ist, ergeben sich unterschiedliche Isomere aus der Heck-Reaktion. Während Akzeptor-substituierte Olefine eher das trans-Produkt liefern, werden aus Donor-substituierten Olefinen eher Produkte mit terminaler Doppelbindung erhalten. Während diese Selektivität für Akzeptor-substituierte Olefine meist sehr hoch ist, werden im Falle von Donor-substituierten Olefinen starke Gemische aus terminaler Doppelbindung und trans-Produkt erhalten. Dies lässt sich über die Elektrophilie der kationischen Pd-(II)-Spezies erklären, die im Insertionsschritt selbst an die elektronenreichste Position addiert. Eine praktisch analoge Erklärung kann auch durch das HSAB-Konzept erhalten werden.
Literatur
- R. F. Heck, J. P. Nolley, Jr.: Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides, J. Org. Chem., 1972, 37(14), S.2320–2322.
Siehe auch
Wikimedia Foundation.