- Hydronium-Ion
-
Oxonium (auch Oxidanium) ist die Bezeichnung für protoniertes Wasser (H3O+) und gehört nach IUPAC zu den Wasserstoffionen. Die Bezeichnungen Hydroxonium oder Hydronium sind veraltet und sollten nach den Empfehlungen der chemischen Nomenklatur nicht mehr verwendet werden, sind aber in der Literatur noch weit verbreitet. In der Literatur versteht man unter Oxoniumion auch häufig nur ein Sauerstoffkation mit drei Bindungen. In dieser Definition ist H3O+ ein Spezialfall. Im Englischen versteht man unter "oxonium ion" ausschließlich die allgemeiner gefasste Definition.
Der pKs-Wert des Oxoniumions beträgt −1,74.
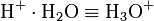
- Oxoniumion
Oxoniumionen entstehen durch Autoprotolyse des Wassers, wobei ein Proton (H+) von einem Wassermolekül auf ein anderes übergeht. Im Gleichgewicht liegt in neutralem Wasser, bei einer Temperatur von 25 °C, eine Stoffmengenkonzentration der Oxoniumionen (ebenso der Hydroxidionen) von 10−7 mol/l vor, wodurch der neutrale pH-Wert 7 definiert wird.
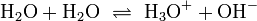
- Durch die Autoprotolyse des Wasser entstehen auch in neutralem Wasser ständig Oxonium- und Hydroxidionen, welche wieder zu Wassermolekülen zurück reagieren.
Durch Zugabe von Säuren erhöht sich diese Gleichgewichtskonzentration durch Übergang der Protonen von der Säure auf Wassermoleküle, der pH-Wert wird erniedrigt. In alkalischen Lösungen wird der pH-Wert erhöht, da die Konzentration von Oxoniumionen kleiner wird.
Die Lebensdauer des Oxoniumions ist sehr kurz (etwa 10−13 Sekunden), da das angelagerte Proton sehr leicht an ein anderes Wassermolekül weitergegeben wird:

- Übertragung eines Protons von einem Wassermolekül auf ein anderes.
In Lösung findet ein kontinuierlicher Übergang zwischen unterschiedlich hydratisierten Protonen statt. Beim Transfer wird dabei stets ein Proton von einem Sauerstoffatom zum nächsten weitergereicht. Dabei verändern sich die Positionen der einzelnen Atome nur minimal. Diese Defektwanderung, die auch als Grotthuss-Mechanismus bezeichnet wird, ist Ursache für die im Vergleich zu anderen Ionen hohe Ionenäquivalentleitfähigkeit von Protonen von 315 S·cm3·mol−1.
Das Zundel-Ion und das Eigen-Ion stellen bei diesem Prozess die begrenzenden Spezies dar. Das Zundel-Ion kann formell als Proton, das von zwei Wassermolekülen hydratisiert wird, betrachtet werden:
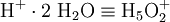
- Zundel-Ion(+1)
Dagegen ist das Eigen-Ion (formell [H9O4]+ bzw. Tetraoxidanium) formell ein von drei Wassermolekülen hydratisiertes Oxonium.
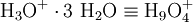
- Eigen-Ion(+1)
Da diese Hydratisierung in wässriger Lösung bei Berechnungen keine Rolle spielt, wird üblicherweise die Schreibweise H3O+ (das eigentliche Oxoniumion) oder sogar nur H+ (Hydron) verwendet. Freie Protonen kommen in wässrigen Lösungen praktisch nicht vor.
Oxoniumsalze
Stabile Oxoniumsalze werden nur von den allerstärksten Säuren, z. B. der Perchlorsäure, gebildet:
![\mathrm{H_2O + HClO_4 \longrightarrow [H_3O]ClO_4}](/pictures/dewiki/54/657e60bfeae3a142e0830b647eb1ffc7.png)
- Wasser wird durch Perchlorsäure protoniert. Dabei entsteht ein Oxoniumion und das Perchloratanion. Beide zusammen bilden das Oxoniumsalz.
Oxoniumionen in der organischen Chemie (Auswahl)
Bei der Behandlung von Ethern R–O–R mit Halogensäuren (Beispiel: Salzsäure) entstehen Oxoniumionen als reaktive Zwischenprodukte, die dann weiterreagieren zu einem Alkohol R–O–H und einem Halogenalkan R–Hal. Bei der Reaktion von Alkoholen R–O–H mit Halogensäuren (Beispiel: Salzsäure) entstehen ebenfalls hochreaktive Oxoniumionen, die unter Wasserabspaltung Halogenalkane R–Hal liefern.
Weiterführende Literatur
- Hans Beyer und Wolfgang Walter, Lehrbuch der Organischen Chemie, 20. Auflage, S. Hirzel Verlag, Stuttgart, 1984, ISBN 3-7776-0406-2.
- Norman N. Greenwood und A. Earnshaw, Chemie der Elemente, Verlag Chemie, Weinheim, 1988, ISBN 3-527-26169-9.
- F. Albert Cotton und Geoffrey Wilkinson, Anorganische Chemie, 2. Auflage, VEB Deutscher Verlag der Wissenschaften, Berlin, 1968.
Wikimedia Foundation.
