- Magnetresonanzspektroskopie
-
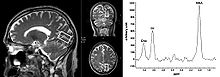 Magnetresonanzspektroskopie eines Abschnittes im Gehirn eines Patienten. In den drei linken MRT-Aufnahmen wird das Messgebiet durch den weißen Kasten markiert. Rechts das dazugehörige NMR-Spektrum mit den Peaks von NAA (N-Acetylaspartat) Cho (Cholin) und Cr (Creatin/Phosphocreatin)
Magnetresonanzspektroskopie eines Abschnittes im Gehirn eines Patienten. In den drei linken MRT-Aufnahmen wird das Messgebiet durch den weißen Kasten markiert. Rechts das dazugehörige NMR-Spektrum mit den Peaks von NAA (N-Acetylaspartat) Cho (Cholin) und Cr (Creatin/Phosphocreatin)
Als Magnetresonanzspektroskopie (MRS) wird in der Medizin und Biochemie ein auf der Kernspinresonanz basierendes Verfahren bezeichnet, mit dem biochemische Beobachtungen ortsaufgelöst in einem Volumenelement durchgeführt werden können. Damit können verschiedene chemische Substanzen (→Metaboliten) im lebenden Gewebe aufgrund ihrer chemischen Verschiebung identifiziert und quantifiziert werden.[1]
Inhaltsverzeichnis
Grundlagen
Die Magnetresonanzspektroskopie (MRS) leitet sich von der NMR-Spektroskopie ab und bezeichnet gewöhnlich die In-vivo-Methode zur Messung von Metaboliten-Konzentrationen in verschiedenen Geweben[2]. Am häufigsten werden dabei Messungen an den per NMR am besten zugänglichen und in biologischen Geweben in großer Menge vorhandenen Wasserstoff-(1H)-Kernen durchgeführt, seltener auch an Phosphor (31P) oder Kohlenstoff (13C)[3]. (Weitere Grundlagen zur NMR-Spektroskopie dort.)
Mit Hilfe der 1H-MRS an einer klinischen Magnetresonanztomografie-Anlage können N-Acetylaspartat als neuronaler Marker oder Cholin-enthaltende Moleküle als Zellmembran-Marker nachgewiesen werden. Außerdem sind Laktat und Citrat sowie die CH2- und CH3-Gruppen von Lipiden und anderen Makromolekülen detektierbar. Die 31P-MRS dient hauptsächlich zur Untersuchung des zellulären Energiestoffwechsels, während die 13C-MRS einen Einblick in den zellulären Glucose-Stoffwechsel gewährt.[4] Klinische Studien sind hauptsächlich an Gehirn, Skelettmuskel, Herz, Leber und Prostata durchgeführt worden.[4][5] In den letzten Jahren haben klinische MRS-Studien in der Onkologie deutlich zugenommen.[6]
Technik
Die MRS ermöglicht es, biochemische Eigenschaften von Gewebe darzustellen und Unterschiede von der physiologischen Norm zu erkennen. So enthält gutartiges Prostatagewebe mehr Zitrat, aber weniger Cholin als das Entartete.[7] Am lebenden Gehirn ermöglicht sie, den Stoffwechsel der Phospholipide und energiereichen Phosphate darzustellen.[8]
Bei der MRS kann ein bestimmtes Volumen, das vorher auf Übersichtsbildern positioniert wird, in einem Gewebe gemessen werden. Diese Methode wird auch als Single-Voxel-Spektroskopie (SVS) bezeichnet.[9] Es ist auch möglich, mehrere Voxel gleichzeitig zu messen, wobei ein größeres lokalisiertes Volumen durch Phasenkodierung in mehrere kleine Volumina unterteilt wird. Diese Methode nennt sich Multivoxel-Spektroskopie oder Chemical Shift Imaging und kann in zwei oder drei Dimensionen ausgeführt werden.[10]
Einsatzbereiche
Prostatakarzinom: Kombiniert mit einer Magnetresonanztomographie kann die dreidimensionale MRS bei übereinstimmenden Ergebnissen beider Verfahren mit einer Wahrscheinlichkeit von ca. 90 % auf das Vorliegen von bösartig entartetem Prostatagewebe hinweisen. Die Kombination beider Verfahren kann sowohl bei der Planung von Biopsien und Therapien der Prostata, als auch zur Kontrolle des Erfolges einer Therapie hilfreich sein.[7]
Im Rahmen der Schizophrenieforschung wird sie ebenfalls verwendet.[8]
Siehe auch
- Computertomographie (CT)
- Magnetresonanztomographie (MRT)
- Funktionelle Magnetresonanztomographie (fMRT)
Einzelnachweise
- ↑ C. Geppert: Methodische Entwicklungen zur spektroskopischen 1H-NMR-Bildgebung. Cuvillier Verlag, 2005, ISBN 3865375103, S. 104 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ D. A. Porter, M. A. Smith: Magnetic resonance spectroscopy in vivo. In: Journal of biomedical engineering. 10, Nr. 6, 1988, S. 562–568 (PMID 3070174).
- ↑ Robert W. Prost: Magnetic resonance spectroscopy. In: Medical Physics. 35, Nr. 10, 2008, S. 4530–4544, doi:10.1118/1.2975225.
- ↑ a b I. Jane Cox: Development and applications of in vivo clinical magnetic resonance spectroscopy. In: Progress in Biophysics and Molecular Biology. 65, Nr. 1–2, S. 45–81, doi:10.1016/S0079-6107(96)00006-5.
- ↑ A. Shukla-Dave, H. Hricak, P. T. Scardino: Imaging low-risk prostate cancer. In: Current opinion in urology. 18, Nr. 1, 2008, S. 78–86, doi:10.1097/MOU.0b013e3282f13adc.
- ↑ J. L. Spratlin, N. J. Serkova, S. G. Eckhardt: Clinical applications of metabolomics in oncology: a review. In: Clinical Cancer Research. 15, Nr. 2, 2009, S. 431–440, doi:10.1158/1078-0432.CCR-08-1059.
- ↑ a b U. G. Mueller-Lisse, M. Scherr: 1H-MR-Spektroskopie der Prostata: Ein Überblick. In: Der Radiologe. 43, Nr. 6, 2003, S. 481–488, doi:10.1007/s00117-003-0902-y.
- ↑ a b S. Riehemann, H.P. Volz, S. Smesny, Gabriele Hübner, B. Wenda, Grit Rößger, H. Sauer: 31Phosphor-Magnetresonanzspektroskopie in der Schizophrenieforschung Zur Pathophysiologie des zerebralen Stoffwechsels energiereicher Phosphate und Membranphospholipide. In: Der Nervenarzt. 71, Nr. 5, 2000, S. 354–363, doi:10.1007/s001150050569.
- ↑ J. Frahm, H. Bruhn, M. L. Gyngell, K. D. Merboldt, W. Hänicke, R. Sauter: Localized high-resolution proton NMR spectroscopy using stimulated echoes: Initial applications to human brain in vivo. In: Magnetic Resonance in Medicine. 9, Nr. 1, 1989, S. 79–93, doi:10.1002/mrm.1910090110.
- ↑ Oded Gonen, James B. Murdoch, Radka Stoyanova, Gadi Goelman: 3D multivoxel proton spectroscopy of human brain using a hybrid of 8th-order hadamard encoding with 2D chemical shift imaging. In: Magnetic Resonance in Medicine. 39, Nr. 1, 1998, S. 34–40, doi:10.1002/mrm.1910390108.
Wikimedia Foundation.
