- Cholin
-
Strukturformel 
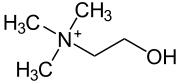
Allgemeines Name Cholinchlorid Andere Namen - (2-Hydroxyethyl)- trimethylammoniumchlorid
- 2-Hydroxy-N,N,N-trimethyl- ethanaminiumchlorid
- Biocolina
- Hepacholine
- Lipotril
Summenformel C5H14ClNO CAS-Nummer 67-48-1 PubChem 305 ATC-Code A05[1]
DrugBank DB00122 Kurzbeschreibung farbloser, hygroskopischer Feststoff mit schwach aminartigem Geruch[1]
Eigenschaften Molare Masse 139,62 g·mol−1 Aggregatzustand fest
Schmelzpunkt Zersetzung bei 180 °C[2]
Löslichkeit - gut in Wasser, Methanol und Ethanol[1]
- schlecht in Tetrachlormethan, Chloroform, Benzol[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [3] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [3] EU-Gefahrstoffkennzeichnung [3] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 24/25 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cholin (von gr. χολή cholé = Galle) ist ein primärer, einwertiger Alkohol und eine quartäre Ammoniumverbindung. Kommerziell erhältlich ist zumeist das Cholinchlorid.
Inhaltsverzeichnis
Geschichte
Cholin wurde im Jahre 1849 von Adolph Strecker zuerst in Schweinegalle[4] entdeckt und 1862 charakterisiert und benannt.[5] 1866 und 1867 wurde es erstmals chemisch synthetisiert, unabhängig voneinander von Adolf Baeyer und Charles Adolphe Wurtz.[6][7]
Vorkommen
Cholin ist unter Lebewesen sehr verbreitet. In Form seines Essigsäureesters bildet es den Neurotransmitter Acetylcholin, in Form seines Phosphorsäureesters ist es Bestandteil der Lecithine (Phosphatidylcholine) und außerdem Zwischenprodukt des Stoffwechsels.
Gewinnung und Darstellung
Cholin kann durch erschöpfende Methylierung der Aminfunktion des Monoethanolamins dargestellt werden. Eine andere Synthese besteht in der Umsetzung von Trimethylamin mit Ethylenoxid.
Verwendung
In Nahrungsergänzungsmitteln, Futtermitteln, Präparaten gegen Leberschäden (Fettleber).
In der Halbleiterproduktion wird Cholin als Reinigungsmittel für Wafer eingesetzt.
In der Biotechnologie findet Cholinchlorid Verwendung in Kulturmedien für Pflanzen.[8]
In Form von 18F-Cholin wird es in der Positronen-Emissions-Tomographie als Tracer bei der Diagnostik des Prostatakarzinoms eingesetzt.
Biologische Bedeutung
Durch die Übertragung eines Acetyl-Restes auf das Cholin durch die Cholin-Acetyltransferase (EC 2.3.1.6) erfolgt die Biosynthese des wichtigen Neurotransmitters Acetylcholin. In Umkehrung dieser Reaktion ist die Acetylcholinesterase für die Hydrolyse dieses Esters zu Essigsäure und Cholin verantwortlich.
Cholin wird durch die Cholinkinase (EC 2.7.1.32) phosphoryliert. Das entstehende zwitterionige O-Phosphocholin dient als Ausgangsstoff der Biosynthese von Phosphatidylcholinen, die essentieller Bestandteil von Biomembranen sind.
Cholin kann weiterhin zu Betain, dem zwitterionigen Trimethylglycin, oxidiert werden, welches neben Folsäure, S-Adenosylmethionin und Vitamin B12 ein wichtiger Methylgruppenüberträger im Metabolismus ist.
Verschiedene Ester des Cholins, z. B. das als Suxamethonium bekannte Succinyldicholin, wirken als Agonisten der Acetylcholin-Rezeptoren, ohne von vorhandenen Cholinesterasen schnell abgebaut werden zu können. Nach kurzer Erregung kommt es zu einer langanhaltenden Depolarisation und damit zur Muskelrelaxation.
Cholin wurde früher – wie auch das Adenin – als Vitamin B4 bezeichnet. Cholin ist jedoch kein essentieller Nährstoff: Bei adäquater Versorgung mit Aminosäuren, insbesondere Serin und Methionin, kann Cholin in ausreichender Menge im Körper gebildet werden. Daneben wird es bei monogastrischen Tieren auch durch die Nahrung aufgenommen, da Cholin als Bestandteil von Phosphatidylcholinen in der Zellmembran vorhanden ist. Wiederkäuer bilden hier eine Ausnahme, da Cholin nahezu vollständig im Pansen abgebaut wird.
Siehe auch
Literatur
- Wolfgang Herrmann, Rima Obeid (Hrsg.): Vitamins in the prevention of human diseases. Gruyter, 2011, ISBN 978-3-11-021448-2, S. 599–628.
Weblinks
Einzelnachweise
- ↑ a b c Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ Datenblatt Cholin bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b c Eintrag zu Cholinchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Mai 2008 (JavaScript erforderlich).
- ↑ Adolph von Strecker: Beobachtungen über die Galle verschiedener Thiere. In: Annalen der Chemie und Pharmacie. 70, Nr. 2, 1849, S. 149–197, doi:10.1002/jlac.18490700203.
- ↑ A. Strecker: Ueber einige neue Bestandtheile der Schweinegalle. In: Annalen der Chemie und Pharmacie. 123, Nr. 3, 1862, S. 353–360, doi:10.1002/jlac.18621230310.
- ↑ Adolf Baeyer: Synthese des Neurins. In: Annalen der Chemie und Pharmacie. 140, Nr. 3, 1866, S. 359–364, doi:10.1002/jlac.18661400308.
- ↑ A. Wurtz: Ueber eine neue Klasse zusammengesetzter Ammoniake. In: Annalen der Chemie und Pharmacie. 142, Nr. 3, 1867, S. 306–313, doi:10.1002/jlac.18671420318.
- ↑ Michael E. Horn, Joseph H. Sherrard, Jack M. Widholm: Photoautotrophic Growth of Soybean Cells in Suspension Culture: I. Establishment of Photoautotrophic Cultures. In: Plant Physiol.. 72, Nr. 2, 1983, S. 426–429 (PDF, abgerufen am 7. August 2009).
Kategorien:- ATC-A05
- Reizender Stoff
- Quartäre Ammoniumverbindung
- Alkohol
- Chlorid
- Koenzym/Kofaktor
- Arzneistoff
- Stoffwechselintermediat
Wikimedia Foundation.
