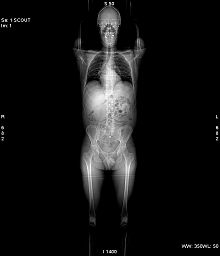
- Computertomographie
-
Die Computertomographie bzw. Computertomografie (von altgriechisch τομή, tome, „Schnitt“ und γράφειν, graphein, „schreiben“), Abkürzung CT, ist ein bildgebendes Verfahren in der Radiologie.
Im Gegensatz zur Röntgentomographie ist in der Computertomographie die Nutzung eines Computers zwingend nötig, um aus den Rohdaten Schnittbilder erzeugen zu können - daher der Name. Durch rechnerbasierte Auswertung einer Vielzahl, aus verschiedenen Richtungen aufgenommenen Röntgenaufnahmen eines Objektes werden Schnittbilder erzeugt. Alternative Bezeichnungen sind CT-Scan oder CAT-Scan (von computed axial tomography).
Obgleich die ersten Geräte im Jahre 1972 nur eine - im Vergleich zu heutigen Geräten - sehr eingeschränkte Funktionalität hatten, wurde die Computertomographie von den Radiologen sofort akzeptiert, denn die Bilder hatten einen hervorragenden Weichteilkontrast. Damit konnten erstmals Gewebearten mit sich nur gering voneinander unterscheidender Schwächung für Röntgenstrahlung dargestellt werden, was bisher nur sehr eingeschränkt möglich war.[1]
Verwandte Verfahren sind die Digitale Volumentomographie und die Rotationsangiographie.
Inhaltsverzeichnis
Funktionsweise
Beim herkömmlichen Röntgenverfahren wird das abzubildende Objekt von einer Röntgenquelle durchleuchtet und auf einem Röntgenfilm abgebildet. Es entsteht eine Projektion des Volumens auf eine Fläche. In Strahlrichtung hintereinander liegenden Bildteilen des durchleuchteten Körpers überlagern sich zwangsläufig. Dadurch kann beispielsweise nicht unterschieden werden, ob die im Röntgenbild sichtbare Schwächung (helle Bereiche im Bild) durch ein Material höherer Absorption oder durch eine größere Schichtdicke hervorgerufen wurde (siehe Lambert-Beersches Gesetz).
In der Computertomographie werden Absorptionsprofile des Objekts aus vielen Richtungen erstellt und daraus die Volumenstruktur rekonstruiert. Im Gegensatz zum klassischen Röntgen bestehen die gemessenen Daten nicht aus einem zweidimensionalen Bild, sondern sind ein eindimensionales Absorptionsprofil. (In heutigen Geräten werden bei einem Röhrenumlauf jedoch mehrere, bis zu 320 derartige Zeilen ausgelesen.)
Erst durch die computergestützte Bildrekonstruktion, die heute mit dem Algorithmus der gefilterten Rückprojektion erfolgt, kann für jedes Volumenelement des Objektes (sog. Voxel, entspricht einem dreidimensionalen Pixel) der Absorptionsgrad ermittelt und das Bild errechnet werden.[2][3]
Das errechnete Bild ist ein Transversalschnitt durch das Untersuchungsobjekt. Mit mehreren aufeinander folgenden Röhrenumläufen lassen sich angrenzende Schnitte erzeugen. Volumengrafiken setzen sich aus mehreren Dutzend, bis zu mehreren hundert Einzelschnitten zusammen.
Für die Bildentstehung beim Computertomographen ist ein Computer zwingende Voraussetzung, da das Bild nicht wie beim klassischen Röntgenverfahren unmittelbar entsteht, sondern erst aus den gemessenen Daten errechnet werden muss. Für die Berechnung eines CT-Bildes sind Projektionen nötig, die mindestens eine 180°-Rotation um das abzubildende Objekt abdecken.
Geschichte
 Der erste klinische CT der Firma EMI
Der erste klinische CT der Firma EMI
Die mathematischen Grundlagen der heute genutzten Computertomographie wurden 1917 durch den österreichischen Mathematiker Johann Radon entwickelt. Die Radontransformation bildet die Grundlage zur Berechnung räumlicher Aufnahmen eines Objektes und seiner von Röntgenstrahlen durchdringbaren Innenstruktur mit Hilfe der gefilterten Rückprojektion.
Allan M. Cormack erarbeitete zwischen 1957 und 1963 Studien über die Absorption von Röntgenstrahlung durch menschliche Gewebe und entwickelte unabhängig von Radons Arbeiten dazu passende mathematische Methoden; er postulierte darauf aufbauend, dass auch geringe Absorptionsunterschiede darstellbar seien. Wie sich Cormack 1992 erinnerte, musste er das mathematische Problem allerdings selbst lösen, da er erst 1972 durch Zufall von Radons grundlegender Arbeit erfuhr.[4] Im Rahmen seiner Nachforschungen entdeckte er auch, dass Radon seinerseits auf Vorarbeiten von Hendrik Antoon Lorentz hätte zurückgreifen können, die ihm aber ebenfalls nicht bekannt waren.[1] Unter anderem in Ermangelung eines Computers konnte Cormack seine Ideen jedoch nicht in Form konkreter Apparaturen umsetzen.
Erst der bei EMI angestellte Elektrotechniker Godfrey Hounsfield realisierte im Jahr 1969 Prototypen und brachte sie zur Marktreife. Auch er kannte die Vorarbeiten von Cormack nicht und musste die Algorithmen für die Bildrekonstruktion aufwändig selbst entwickeln.[1]
Bei Hounsfields ersten Laborgeräten wurde im Jahr 1969 noch eine Isotopenquelle als Strahlenquelle verwendet und die Abtastzeit betrug 9 Tage.[1]
Nach einer Reihe von Tieruntersuchungen zum Beleg der Unbedenklichkeit wurde die erste CT-Aufnahme an einem Menschen im Jahr 1971 aufgenommen. Schon 1972 wurde der erste kommerzielle Computertomograph, der EMI Mark 1, für die klinische Anwendung im Londoner Atkinson Morley Hospital installiert. [5] Ende 1974 hatte EMI 60 derartige Scanner verkauft und installiert. Cormack und Hounsfield erhielten für ihre Arbeiten 1979 gemeinsam den Nobelpreis für Physiologie oder Medizin.
Meilensteine der CT-Entwicklung
Die Geschichte der Computertomographie ist voller Innovationen, die alle Teilbereiche des Gerätes betreffen. Sie betreffen die Anordnung und Bauart von Gantry, Röhre und Detektor, aber auch die für die Bildrekonstruktion verwendeten Algorithmen. Die Entwicklungsschritte waren insbesondere in den Anfangsjahren der Computertomographie groß und zielten in dieser Zeit vor allem auf eine Verkürzung der Untersuchungszeit ab.
Gerätegenerationen
Die Änderungen der Art der Datenerfassung (Anordnung, Bewegung und Bauart von Röhre und Detektor) waren so fundamental, dass sie mit dem Begriff „Gerätegeneration“ beschrieben wurden. Diese Zählung hörte jedoch mit der 5. Generation auf. Praktisch alle heute auf dem Markt angebotenen Computertomographen für die Diagnostik am Menschen sind Rotate-Rotate-Geräte, also Geräte der 3. Generation.[1]
- Translation-Rotations-Scanner – Bei diesen Geräten der ersten Generation war eine Röntgenröhre, die einen Nadelstrahl aussandte, einem einzelnen Detektor zugeordnet. Detektor und Röhre bewegten sich translatorisch im festen Abstand zueinander und tasteten die zu untersuchende Schicht so ab wie - bildhaft gesprochen - eine Bandsäge ein Stück Holz durchsägt. Das Stück Holz entspricht dem Untersuchungsobjekt (= Kopf des Patienten) und das Sägeblatt dem Röntgenstrahl. Nach jeder solchen Aufnahme, bei der 160 Messwerte erfasst wurden, drehte sich Röhre und Detektor um 1° um die Mitte des Untersuchungsobjektes und tasteten erneut eine Zeile ab. Der EMI Mark 1 nahm so in 5 Minuten 180 Projektionen auf. Der Detektor war zweizeilig, die Schichtdicke betrug 13 mm, die Auflösung 3 Linienpaare/cm. Nach einer Rechenzeit von 35 Minuten konnten 6 x 2 Bilder in einer Matrix von 80 x 80 = 6400 Bildpunkten, errechnet aus insgesamt 28.800 Daten, dargestellt werden.[1]
- Geräte der zweiten Generation, die ebenfalls schon 1972 auf den Markt kamen, tasteten das Untersuchungsobjekt auf dieselbe Weise ab, es kam jedoch ein Fächerstrahl zur Anwendung, der auf 10 Detektoren projizierte. Auch nahezu alle Geräte der zweiten Generation waren reine Schädelscanner, die lediglich Aufnahmen vom Kopf ermöglichten. ACTA (automated computerized transverse axial), der erste in Washington im Jahr 1973 installierte „Körperscanner“, ermöglichte erstmals auch Aufnahmen von Brust- und Bauchraum. Er funktionierte ebenfalls nach dem Translations-Rotationsprinzip und hatte ein axiales Gesichtsfeld von 48 cm, das er während einer 6 Minuten dauernden Aufnahme abtastete.[1][6]
- Rotate-Rotate-Geräte – Die Röhre muss hier keine translatorische Bewegung mehr durchführen, da ein Fächer von Strahlen ausgesendet wird, welcher den gesamten Bereich durchleuchtet. Sie wird nur noch um den Patienten gedreht, ein auf der gegenüberliegenden Seite des drehenden Teils angebrachtes Kreissegment von Detektorzellen nimmt den Fächer auf. Diese Geräte der 3. Generation kamen im Jahr 1975 auf den Markt und erlaubten erstmals, binnen 20 Sekunden die Daten einer Schicht zu erfassen. Hierdurch war es möglich, den Brust- und Bauchbereich während einer Atemanhaltephase aufzunehmen und damit die bisher unvermeidbaren Atmungsverwischungen zu vermeiden.
- Rotate-Stationary-Geräte – Bei diesen Geräten rotiert nur noch die Röntgenröhre um den Patienten herum, während die Detektoren in einem vollen 360°-Kreis um den Patienten angebracht sind. Diese 4. Generation folgte im Jahre 1978, konnte sich aber nicht durchsetzen und verschwand bald wieder vom Markt.
- Elektronenstrahl-Scanner – Diese Geräte der 5. Generation wurden ca. bis zur Jahrtausendwende gebaut. Es bewegen sich hier keine mechanischen Komponenten mehr. Um den Patienten herum befindet sich ein 360°-Kreis mit Detektoren und ein Ring aus einem Material wie zum Beispiel Wolfram, welches als Target (Ziel) für den Elektronenstrahl einer Elektronenkanone dient. Nach dem Prinzip einer Braunschen Röhre wird dieser Elektronenstrahl, mittels elektromagnetischer Felder, jeweils zur gewünschten Position auf dem Targetring gelenkt. Wo er auftrifft, entsteht Röntgenstrahlung, die den Patienten durchleuchtet. Um die vollen 360 Grad des Ringes abdecken zu können, werden mehrere Elektronenkanonen und Ablenkanordnungen verwendet, die in regelmäßigen Abständen um das Target herum angebracht sind. Durch diese Technik konnten extrem schnell Bilder erzeugt werden, sogar Echtzeitaufnahmen vom schlagenden Herzen waren möglich, da sich während der Aufnahme keine mechanischen Teile bewegten, sondern lediglich der Elektronenstrahl um den Patienten geführt werden musste. Dies war im Millisekundenbereich möglich, während die schnellsten CTs selbst heute für eine 360°-Aufnahme noch mehrere zehntel Sekunden benötigen. Diese Geräte haben sich wohl aufgrund des hohen technischen Aufwands und damit des hohen Preises im medizinischen Alltag nicht durchgesetzt, wurden jedoch aufgrund ihrer hohen zeitlichen Auflösung von bis zu 30 ms in der Kardiologie sehr lange verwendet.[7] CT-Aufnahmen des Herzens hoher Qualität können heute mit hochzeiligen Spiral-CTs (64-640 Zeilen) in vergleichbarer bzw. besserer Qualität bei weit geringeren Kosten erstellt werden.
Schleifringtechnik
Einblick in einen geöffneten Computertomographen mit Röhre und Detektor in Rotation.
Auch bei den CTs der 3. Generation waren Röhre und Detektor anfangs über Kabel mit der Gantry verbunden, weswegen nach einer erfolgten 360°-Umdrehung die Röhre zurückgedreht werden musste. Die kürzeste mögliche Aufnahmezeit betrug mit dieser Technik bei den schnellsten Geräten zwei Sekunden. Kliniker wünschten jedoch noch schnellere Aufnahmen und so kamen die ersten Computertomographen mit Schleifringtechnologie auf den Markt. Die ersten „Dauerrotierer“ wurden im Jahr 1987 von den Firmen Siemens (Somatom Plus) und Toshiba (TCT 900S) auf den Markt gebracht.[1] Die kürzeste Zeit für eine volle 360°-Umdrehung lag bei diesen Geräten bei etwa einer Sekunde.
Spiral- oder Helix-CT
In der Anfangszeit der Computertomographie wurde ausschließlich axial gescannt. Bei diesem Aufnahmeverfahren wurde der Tisch nach jeder vollen 360°-Rotation der Röhre um den Patienten ein klein wenig verschoben. Der Verschiebeweg war so groß wie die gewählte Schichtdicke, also ca. 5-15 mm. Zum Verfahren des Tisches war mehr als genug Zeit, da sich die Röhre in Gegenrichtung zurückdrehen musste, schließlich waren Röhre und Detektorsystem über Kabel mit der Gantry verbunden. Jedoch wurde dieser Modus auch nach Einführung der „Dauerrotierer“ im Jahr 1987 zunächst beibehalten. Damit fiel lediglich das Zurückdrehen der Röhre weg. Eine Aufnahme bestand also aus einer kontinuierlichen Röhrenrotation bei schrittweisem Tischvorschub, der nach jeder vollen Röhrenumdrehung erfolgte. Ein Spiralmodus, bei dem sich sowohl Röhre wie auch Detektorsystem kontinuierlich bewegen, war zwar verschiedentlich diskutiert und publiziert worden. Aber die Mehrheit der Hersteller lehnte eine derartige Aufnahmetechnik ab. Eine Verschiebung des Patienten während der Röhrenrotation galt als Quelle schwerer Bildartefakte und die Spiral-CT wurde spöttisch als „Methode zur Erzeugung von Artefakten in der CT“ bezeichnet.[1]
Dennoch führte der deutsche Physiker Willi A. Kalender im Jahr 1989 die Spiral-CT erfolgreich ein.[5] Das erste Gerät, das in diesem Modus arbeitete, war der Siemens Somatom Plus. Die gefürchteten Artefakte konnten mit dem Algorithmus der „Z-Interpolation“ beseitigt werden. Innerhalb von 2 Jahren brachten auch alle anderen großen CT-Hersteller Geräte heraus, die im Spiral-Modus arbeiten, das Verfahren war akzeptiert. Die schnelle Verbreitung war möglich, da zur damaligen Zeit Algorithmen nicht patentierbar waren, die Z-Interpolation daher von allen Herstellern übernommen werden konnte.[1] Alle heutigen Geräte arbeiten im Spiralverfahren, bei dem der Patient mit konstanter Geschwindigkeit entlang seiner Längsachse durch die Strahlenebene bewegt wird, während die Strahlenquellendetektoreinheit mit konstanter Winkelgeschwindigkeit rotiert. Je nach Gerät können mehrere Axialebenen – 2 bis maximal 320 – (Toshiba, Stand 2009) gleichzeitig eingelesen werden (Mehrschicht- oder Multislice-Verfahren). Dadurch ist das Verfahren schneller und es lassen sich Bewegungsartefakte (z. B. durch die Atmung) reduzieren. Neben der hohen Geschwindigkeit ist ein weiterer Vorteil der modernen Mehrschicht-Spiral-CT die Gewinnung von Datensätzen mit isotropen Voxeln. Isotrope Voxel haben die Form von Würfeln mit gleicher Kantenlänge in allen drei Raumrichtungen (Δx = Δy = Δz). Dadurch ist eine multiplanare Reformation in beliebigen Bildebenen (axial, sagittal, koronal) ohne einen Verlust an (Detail-)Auflösung oder auch eine schräge (oblique) und gekrümmte (curved) sowie eine qualitativ hochwertige 3D-Rekonstruktion möglich. In Spiral-CTs werden Hochleistungs-Drehanodenröhren verwendet.
Mehrzeilen- CT
Die Firma Elscint stellte im Jahr 1992 als erster Hersteller einen Computertomographen der dritten Generation vor, der bei einem Röhrenumlauf zwei Schnitte gleichzeitig aufnahm.[8] Alle anderen Hersteller klinischer CTs zogen nach und die Schichtzahl verdoppelte sich auf 4 im Jahr 1998, wuchs über 6 und 8 Zeilen auf 16 im Jahr 2001, weiter auf 20, 32 und 40 Zeilen auf 64 im Jahr 2006 und erreichte mit 640 (320 Zeilen, doppelt ausgelesen) gleichzeitig akquirierbaren Bildzeilen beim Toshiba Aquilion ONE im Jahr 2011 bis heute ihren Gipfel.[9]
Dual-Source-Computertomographie
 Prinzip des Dual-Source-Scanners
Prinzip des Dual-Source-Scanners
Ein Dual-Source-Computertomograph wurde 2005 von Siemens vorgestellt [10]. Im Gegensatz zum herkömmlichen Computertomographen arbeiten im Dual-Source-Computertomographen zwei rotierende, um 90 Grad versetzt angeordnete Röntgenstrahler gleichzeitig. Damit kann die Aufzeichnungszeit halbiert werden, was besonders für die Herzbildgebung nützlich ist. Die beiden Röhren können mit unterschiedlicher Spannung betrieben werden [11].
Zwei-Spektren-CT bzw. Multi-Energy-Computertomographie
Das in der Fotografie für die Bildgebung verwendete sichtbare Licht besteht aus elektromagnetischen Wellen unterschiedlicher Wellenlänge; analog besteht das für die Computertomographie verwendete Röntgenspektrum einer Röntgenröhre ebenfalls aus elektromagnetischen Strahlen unterschiedlicher Wellenlänge. Konventionelle Computertomographen quantifizierten die Schwächung des gesamten einfallenden Röntgenspektrums; die unterschiedliche Absorptionscharakteristik eines Gewebes für unterschiedliche Wellenlängen bleibt dabei unberücksichtigt.
Die Schwächungseigenschaften von Geweben und Kontrastmittel sind von der Photonenenergie der verwendeten Röntgenstrahlung abhängig. Da im CT-Bild die Hounsfield-Werte von Kontrastmittel denen von Kalzifikationen ähneln, ist beispielsweise die Differenzierung zwischen Koronarkalk und Kontrastmittel im konventionellen CT-Bild bisweilen schwierig. Da Kontrastmittel im niederenergetischen Spektrum aber eine deutlich höhere Absorption als im höherenergetischen Spektralbereich zeigt, kann mit Hilfe der Multi-Energy-Computertomographie eine Differenzierung zwischen Kalk und Kontrastmittel erfolgen.
In den 1990er Jahren bot die Firma Siemens mit dem Somatom DR ein Gerät an, mit dem zwei Aufnahmen, die mit unterschiedlichen Strahlenspektren gewonnen, überlagert und ausgewertet werden konnten.[12] Dieses, von Siemens „Zwei Spektren CT“ genannte Verfahren, erlaubte schon damals, präzise Knochendichtemessungen durchzuführen, sowie Bilder zu errechnen, die aussahen, als wären sie mit monochromatischer Röntgenstrahlung erstellt worden. Außerdem waren sie vollkommen frei von Artefakten, die durch Strahlaufhärtung verursacht werden. Das Verfahren setzte sich jedoch nicht durch. Es führte zu doppelter Strahlenbelastung und doppelter Untersuchungszeit, was als dem klinischen Gewinn nicht angemessen betrachtet wurde.
Mit dem Dual-Source-Computertomograph Somatom Definition der Firma Siemens können erneut Aufnahmen mit unterschiedlichen Strahlenqualitäten angefertigt werden, indem die Röhrenspannungen der beiden Röhren unterschiedlich eingestellt wird. [13] Die Untersuchungszeit bleibt durch den gleichzeitigen Einsatz von zwei Röntgenröhren unverändert.
Die Firma General Electric stellte im Jahr 2008 mit dem CT750 HD ebenfalls einen Computertomographen vor, der eine Aufnahmetechnik mit zwei Spektren ermöglicht, was vom Hersteller „Dual Energy CT“ genannt wird.[14] Dieses System verwendet jedoch eine einzelne Röhre, deren Röhrenspannung im Millisekundenbereich zwischen zwei Energieniveaus wechseln kann. Da der neu entwickelte Detektor eine extrem kurze Abklingzeit hat, können bei einem Röhrenumlauf ohne zusätzliche Untersuchungszeit und Strahlenbelastung zwei Aufnahmen durchgeführt werden. Das Gerät war gleichzeitig der weltweit erste Scanner, für den eine iterative Bildrekonstruktion kommerziell erhältlich war, womit die Strahlenbelastung sogar unter die einer herkömmlichen CT-Untersuchung gesenkt werden konnte.[15][16]
Iterative Bildrekonstruktion
Vom CT aufgenommene Rohdaten wurden mit Ausnahme der allerersten Geräte (EMI Mark1) durchgängig mit Hilfe der gefilterten Rückprojektion in Schnittbilder umgerechnet. Mit erheblich rechenintensiveren iterativen Bildrekonstruktionsalgorithmen kann die für eine Untersuchung nötige Strahlendosis bei gleichbleibender Bildqualität jedoch um 30 bis 60 % gesenkt werden. Bei GE wird der Algorithmus ASIR (Adaptive Statistical Iterative Reconstruction) bzw. MBIR (Model based iterative Reconstruction) genannt; ASIR ist seit dem Jahr 2009 in kommerziell erhältlichen Geräten verfügbar, MBIR noch in Entwicklung; Philips nennt seinen Algorithmus iDose, bei Siemens wird er IRIS (Iterative Reconstruction in Image Space) genannt und bei Toshiba AIDR (Adaptive Iterative Dose Reduction).[17] In ersten Studien konnten durch ASIR Untersuchungen mit im Mittel 2,6 mSv anstatt wie bisher 3,8 mSv durchgeführt werden. Laut Herstellerangaben ist das Potential des Verfahrens bislang (Stand 2010) noch nicht voll ausgenutzt; die Strahlenbelastung kann künftig bei gleichbleibender Bildqualität durch Einsatz von erheblich mehr Rechenleistung nochmals weiter reduziert werden.[18][15]
Anwendungen
Die Computertomographie wird in vielen Bereichen eingesetzt. Für die Untersuchung von Bäumen, zur zerstörungsfreien Untersuchung von archäologischen Funden wie Mumien zur Materialprüfung in der industriellen Computertomographie oder zur Diagnostik von Tiererkrankungen in der Veterinärmedizin.
Die größte Gerätezahl ist jedoch in der Humanmedizin anzutreffen.
Computertomographie in der Humanmedizin
Der CT gehört heute zum wichtigsten Arbeitsmittel des Radiologen, mit dem eine Vielzahl von Erkrankungen diagnostiziert werden kann. 2009 erhielten in Deutschland rund 4,88 Millionen Menschen mindestens eine Computertomographie.[19] Das Verfahren kann überall dort eingesetzt werden, wo ein Leiden bzw. Erkrankungsbild zu einer Veränderung in der Struktur des Körpers führt. Es können damit sehr sicher Knochenbrüche, Blutungen, Blutergüsse, Schwellungen (z.B. von Lymphknoten) und oft auch Entzündungen diagnostiziert werden. Da es überdies auch ein recht schnelles Bildgebungsverfahren ist, sind Computertomographen fast ausnahmslos auch in der Nähe der Notfallaufnahme eines Unfallkrankenhauses zu finden.
Weichteilorgane, Nervengewebe, Knorpel und Bänder sind gut in der CT beurteilbar. Die Darstellung dieser Gewebegruppen ist jedoch eine klare Stärke der Kernspintomographie, weshalb bei diese Organgruppen betreffenden Fragestellungen diesem - teureren und deutlich zeitaufwändigeren - Verfahren oftmals der Vorzug gegeben wird.
Tumore und Metastasen von Krebserkrankungen können prinzipiell auch erkannt werden. Eine Schwierigkeit besteht jedoch darin, dass sich ein Tumor zwar als Raumforderung darstellt, jedoch im Bild nicht sichtbar ist, ob die Ursache dieser Raumforderung tatsächlich ein Tumor (bzw. Metastase) ist. Es ist möglich, dass ein vergrößerter Lymphknoten von Metastasen des Tumors befallen oder aber nur entzündet ist. Ebenso ist zwar ein Tumor in seiner Gestalt bisweilen gut erkennbar, aber es ist nicht erkennbar, ob nach einer stattgehabten Therapie (Chemotherapie oder Strahlentherapie) das im Bild dargestellte Tumorgewebe noch vital ist (also lebt) oder bereits aufgrund der Therapie abgestorben ist. Ebenso sind kleine Metastasen und Tumore oftmals leicht zu übersehen bzw. können nicht hinreichend sicher von normalen Gewebestrukturen unterschieden werden. Die Kombination aus Computertomographie und Positronen-Emissions-Tomographie, die sogenannte PET/CT brachte für die Diagnostik in der Onkologie daher große Fortschritte. Die PET ergänzte, was die CT nicht liefern konnte - und umgekehrt.
Aufnahmemodi
Vor jeder Aufnahme wird grundsätzlich eine Übersichtsaufnahme aufgenommen. Hierbei steht die Röntgenröhre still. Der Patient wird mit Hilfe des verfahrbaren Tisches am Fächerstrahl der Röhre vorbeigefahren. Im Ergebnis erhält man ein Bild, das einer klassischen Röntgenaufnahme sehr ähnlich sieht. Dieses Bild dient jedoch nur der Planung anschließender Aufnahmen.[1]
Bis Mitte der 1990er Jahre war die rein axiale Aufnahme die einzig mögliche Aufnahmeart. Die Röhre drehte sich bei stillstehendem Tisch um eine volle 360° Drehung um den Patienten. Im Anschluss wurde der Tisch verfahren und die nächste Schicht aufgenommen. Jeder klinische CT verfügt bis heute über diesen Modus, da er ein besseres Schichtempfindlichkeitsprofil und damit eine bessere Detailerkennbarkeit bietet. Er wird allerdings mittlerweile selten eingesetzt.[1]
Bei der CT-Fluoroskopie wird auch axial gescannt; es wird an einer bestimmten Position in Zeitintervallen akquiriert. Die Aufnahmeart wird verwendet, um z.B. bei einer Punktion die Biopsienadel zu führen.[1]
Genauso wie bei der CT-Fluoroskopie wird bei der dynamischen CT wiederholt an derselben Position aufgenommen. Aus der Bildfolge kann der zeitliche Verlauf eines physiologischen Vorgangs ermittelt werden. Dies ist meist die Anflutung von CT-Kontrastmittel. Aus der Geschwindigkeit, mit der sich das Kontrastmittel im Untersuchungsbereich verteilt, kann die Durchblutung eines Organes oder Organteils bestimmt werden. Zur Visualisierung kann die Bildfolge als Kino-Sequenz dargestellt werden.
Seit Ende der 1990er Jahre kann die Anatomie des Herzens auch mit Hilfe von Mehrzeilen-CTs dargestellt werden. Bei der Computertomographie des Herzens kann sowohl der axiale als auch der Spiralmodus eingesetzt werden. Das Herz ruht zwar während ca. 70 % der Herzschlagphase, Arrhythmien und Extrasystolen können eine Aufnahme dennoch unbrauchbar machen.[1] Bei den meisten heutigen CTs (2011) muss eine vollständige Aufnahme des Herzens aus Bilddaten zusammengesetzt werden, die im Verlauf von 5 bis 10 Herzschlägen gewonnen wurden.
Die heute (2011) mit Abstand häufigste Aufnahmetechnik ist die sequenzielle Aufnahme im Spiralmodus. Sie kann mit oder ohne gleichzeitigem Einsatz von Kontrastmittel durchgeführt werden.[1]
Ablauf einer typischen CT-Untersuchung
Für eine CT-Untersuchung wird in der Regel wenig Zeit benötigt, da die Technik heute sehr ausgereift und schnell ist. Eine Routineuntersuchung kann in 3 bis 10 Minuten bequem durchgeführt werden.
Patientenvorbereitung, Kontrastmittel und Laborwerte
Vor einer geplanten CT-Untersuchung werden vom Radiologen meist zwei Werte der Laboruntersuchung des Blutes verlangt. Es sind dies der Kreatinin und der Thyreotropin-Wert oder kurz der „Krea- und TSH-Wert“. Der Großteil aller Untersuchungen wird mit Hilfe eines jodhaltigen Konstrastmittels durchgeführt, das intravenös injiziert wird. Im Falle eines bestehenden Jodmangels versucht die Schilddrüse, den dadurch verursachten Thyroxin-Mangel (Jod ist für die Thyroxin-Bildung essenziell) durch eine verstärkte Ausschüttung von TSH zu kompensieren. Die Gabe des jodhaltigen Kontrastmittels würde in einer solchen Situation zu einer schlagartig ansteigenden Thyroxinproduktion führen und eine plötzliche Hyperthyreose auslösen. Ein erhöhter TSH-Wert deutet auf eine derartige Situation hin, so dass diese Komplikation vermieden werden kann.
In sehr seltenen Fällen kann durch das Kontrastmittel auch eine allergische Reaktion hervorgerufen werden, die lebensbedrohlich werden kann. Ist eine Kontrastmittelallergie bekannt, kann dies im Vorfeld medikamentös adressiert werden, so dass keine Gefahr für den Patienten besteht. Da ein sogenannter „Kontrastmittelzwischenfall“, Übelkeit und Erbrechen zur Folge hat, wird empfohlen, zur Untersuchung nüchtern zu kommen, so dass der Magen leer ist und Erbrochenes nicht in die Atemwege gelangen kann.
Das CT-Kontrastmittel wird über die Nieren ausgeschieden und stellt eine Belastung für diese Organe dar. Bei einem gesunden Menschen ist dies kein Problem, vorgeschädigte Nieren könnten jedoch mit der zusätzlichen Last überfordert sein. Über den Kreatininwert wird geprüft, ob eine gegebenenfalls gefährliche Nierenvorschädigung vorliegt.
In Notfallsituationen ist es möglich, dass eine CT-Untersuchung trotz nicht bekannter Blut-Laborwerte trotzdem unter intravenöser Kontrastmittelgabe erfolgt. Hier gilt es, mit Hilfe der kontrastmittelgestützten Aufnahme eine akut lebensbedrohliche Situation sicher zu diagnostizieren.
Das Kontrastmittel wird über eine Hochdruckpumpe injiziert. Dazu wird vor der Untersuchung ein peripherer Venenkatheter gelegt, über den es eingebracht wird. Eine typische Einstellung wäre z.B. 50 ml Kontrastmittel, das mit einer Flussrate von 3 ml/Sekunde verabreicht wird. Im Jargon wird Kontrastmittel auch mit „KM“ und die intravenöse Einbringungsart mit „iv“ abgekürzt,; das Fachpersonal spricht bei Verwendung von intravenös verabreichtem Kontrastmittel dann kurz vom „iv-KM“, die Aufnahme wird KM-Aufnahme bezeichnet. Eine Aufnahme ohne Verwendung von Kontrastmittel wird als „Nativ-Aufnahme“ bezeichnet.
Zusätzlich zu dem beschriebenen intravenösen Kontrastmittel wird bei Untersuchungen des Bauchraums häufig auch Kontrastmittel zum Trinken verwendet. Dieses verbleibt im Wesentlichen im Inneren des Magen-Darm-Traktes und dient so der besseren Darstellung desselben. Die Jod- oder Bariumsulfat-haltige Substanz wird in Wasser gelöst und vor der Untersuchung vom Patienten getrunken. Meist sind Geschmacksstoffe zugesetzt, so dass es beispielsweise nach Anis schmeckt. Typischerweise wird ein Liter Kontrastmittel zu trinken gegeben. Bei Fragestellungen, die den letzten Teil des Darmes betreffen, kann zusätzlich auch noch ein Einlauf mit Kontrastmittel erforderlich sein.
Der Patient sollte sich vor der Untersuchung in dem zu untersuchenden Körperbereich (z. B. Brustkorb) weitgehend entkleiden. Dies ist zwar nicht zwingend nötig, weil die Röntgenstrahlung Kleidungsstücke problemlos durchdringt. Metallgegenstände in der Kleidung sind - so wie bei der Kernspintomographie - jedoch unerwünscht. Während ein nicht entfernter Metallgegenstand in der Kernspintomographie im starken Magnetfeld aber auch ein Unfallrisiko darstellt, werden in der CT damit lediglich unerwünschte Bildartefakte erzeugt, da Metall die Röntgenstrahlung sehr stark absorbiert, was die Darstellung dahinter liegender Körperbereiche stört.
Patientenlagerung und Referenzpunkt
Der Patient legt sich auf den höhenverstellbaren Untersuchungstisch, der zum bequemen Platzieren nach unten gefahren werden kann. Bei Untersuchungen des Kopfes wird der Kopf des Patienten fixiert, um einer Bildunschärfe durch unwillkürliche Kopfbewegungen zuvor zu kommen. Die Arme des Patienten liegen bequem am Körper an.
Um den zu untersuchenden Bereich planen zu können, ist die Definition eines Nullpunktes nötig, auf den sich alle Koordinatenangaben beziehen. Zu diesem Zweck verfährt das Bedienpersonal den Patiententisch hoch in die Untersuchungsebene und in die Gantry hinein. Für eine genauere Planung des Referenzpunktes verfügt ein CT über Positionier-Laser, so dass genau erkennbar ist, wo sich der gewählte Referenzpunkt auf den Körper des Patienten projiziert. Ein beliebter Referenzpunkt ist z.B. die deutsche Horizontale. Damit der Patient beim Setzen dieses Referenzpunktes nicht versehentlich vom Laser geblendet wird, lässt man ihn für einen kurzen Moment die Augen schließen. Der Ort des Referenzpunktes ist jedoch prinzipiell frei wählbar und bezieht sich sinnvollerweise auf die zu untersuchende Region. Soll das Sprunggelenk untersucht werden, ist es folglich zweckmäßig, den Referenzpunkt in der Nähe des Sprunggelenkes zu setzen. Ist der Ort bestimmt, wird mit einem Druck auf eine entsprechende Taste am Gerät das Koordinatensystem des Gerätes auf diesen Punkt „genullt“. Alle Angaben, sowohl im Untersuchungsprotokoll wie im späteren Bild beziehen sich auf diesen Nullpunkt.
Die Planung des Untersuchungsbereichs
In der Regel sind am Gerät für jede mögliche Untersuchung vorkonfigurierte, sogenannte „Untersuchungsprotokolle“ hinterlegt, die der Anwender in Abhängigkeit von der medizinischen Fragestellung wählt. Es ist im Protokoll unter anderem festgelegt, wo der der Referenzpunkt für die Untersuchung zu setzen ist. Die erste Aufnahme jeder Untersuchung ist die Übersichtsaufnahme. In diese Übersichtsaufnahme zeichnet die MTRA mit Hilfe von verschiebbaren Bildkursoren den abzubildenden Bereich ein. Alternativ können Positionsangaben auch manuell numerisch eingegeben werden, wobei die in der Medizin üblichen Lage- und Richtungsbezeichnungen zur Anwendung kommen. Für eine Aufnahme der Lunge mit Referenzpunkt im Brustbein wird dann z.B. eine Übersichtsaufnahme angefertigt, die von superior 300 bis inferior 200 reicht, was bedeutet, dass sie von 300 mm „kopfwärts“ vom Nullpunkt bis 200 mm „fusswärts“ vom Referenzpunkt reicht. Die folgende Schnittbildaufnahme wird sich innerhalb dieses Bereiches befinden.
Das CT-Bild
In den ersten Jahren wiesen CT-Bilder in der transversalen Bildebene eine erheblich höhere Auflösung auf, als in der axialen. Transversalschnitte waren daher damals die einzig sinnvolle Form der Bilddarstellung;[1] Radiologien befunden bis heute bevorzugt Transversalschnitte. Zur Orientierung: Der Betrachter blickt (vom Patienten aus gesehen) von unten auf einen Transversalschnitt, weshalb das, was aus Patientensicht links ist, sich im Bild rechts befindet.
Hounsfield-Skala und Fensterung
Im CT-Bild wird die Schwächung des Gewebes für das von der Röhre emittierte Röntgenspektrum in Form von Grauwerten dargestellt. Die Schwächungswerte werden in sogenannte CT-Zahlen umgerechnet und diese auf der Hounsfield-Skala ausgegeben. Luft hat definitionsgemäß die CT-Zahl -1000 und Wasser den Wert 0. Der Grund für die Umrechnung ist, dass die spektrale Zusammensetzung der Röntgenstrahlung in Abhängigkeit von Aufnahmeparametern und verwendeter Vorfilterung stark variiert. Ein CT-Bild, das Schwächungswerte direkt darstellen würde, würde jeweils unterschiedlich ausfallen. Eine Vergleichbarkeit von Bildern, wie sie für die Befundung in der Medizin unabdingbar ist, wäre so nicht möglich. Durch Normierung der gemessenen Schwächung auf die Schwächungswerte von Wasser und Luft wird dieses Problem umgangen. Für die bildliche Darstellung wird jeder CT-Zahl ein Grauwert zugeordnet. Da das menschliche Auge nicht in der Lage ist, diese 4000 Grauwerte zu differenzieren, wird die Fensterung je nach untersuchtem Organsystem anders gewählt.
Im Fachjargon der Mediziner wird ein Gewebe, das einen niedrigeren Absorptionsgrad aufweist als erwartet, als hypodens (Hypodensität) bezeichnet; bei höherem Schwächungskoeffizienten als hyperdens (Hyperdensität). Zwei Bildpunkte, die Gewebe mit gleichem Absorptionsgrad repräsentieren, sind einander isodens.
Multiplanare Reformation und 3D-Darstellungen
Erst mit der Einführung von Mehrzeilen-Spiral-CTs Mitte der 1990er Jahre gab es in der Computertomographie isotrope Voxel.[1] Da alle heutigen (2011) klinischen CTs kleine isotrope Voxel erzeugen können, sind durch multiplanare Reformation auch sagittale und koronale Darstellungen in hoher Qualität möglich, die für den Nicht-Radiologen erheblich einfacher zu verstehen sind. Durch die auf heutigen Auswerte- bzw. PACS-Workstations preiswert verfügbare Rechenleistung können aus den Daten auch hochwertige 3D-Darstellungen in Form von MIP, Surface-Rendering oder - am aufwändigsten und beeindruckendsten - Raycasting erzeugt werden. Diese Darstellungen sind für den Radiologen in der klinischen Routine von nachrangiger Bedeutung. Raycasting und MIP werden jedoch im Rahmen von Spezialanwendungen für Visualisierungen in der CT-Angiographie, der Computertomographie des Herzens und der virtuellen Koloskopie verwendet.
Sliding thin slab
Die kleinstmögliche Schichtdicke heutiger CTs liegt im Bereich von etwa 0,3 mm. Dünne Schichten erlauben zwar die Darstellung kleinster Bilddetails, sind jedoch der Grund für die - trotz allem technischen Fortschritt - immer noch hohe Strahlenbelastung durch computertomographische Untersuchungen, denn die Höhe des Bildrauschens wird wesentlich von der gewählten Schichtdicke bestimmt. Der Radiologe benötigt für die Befundung nur in seltenen Fällen Schichtdicken von 1 mm und darunter. Auf der anderen Seite können Bilder einer (rauscharmen) dickschichtig rekonstruierten Untersuchung nur in begrenztem Umfang und nur bei Vorliegen der Rohdaten im Nachhinein in dünne Schichten umgerechnet werden. Je größer die Schichtdicke in einem CT-Bild ist, desto rauscharmer ist es, desto größer ist aber auch die Wahrscheinlichkeit, dass sich im Bild Artefakte durch den Partialvolumeneffekt zeigen. Dieses Dilemma kann durch die sliding thin slabs Darstellung (abgekürzt sts) umgangen werden. Die Bilder werden hierbei dünnschichtig (z.B. mit 1 mm Dicke und weniger) rekonstruiert, jedoch dickschichtig (z.B. 5 mm) dargestellt. Beispiel: Bei einer angenommenen 1-mm-Rekonstruktion mit 5-mm-Darstellung werden 5 Schichten addiert. Blättert der Radiologe im Bild, wird der nächste 1-mm-Schnitt in die Darstellung hinzugenommen und der letzte 1-mm-Schnitt entfernt. Es wird wieder ein Bild mit 5 mm effektiver Dicke dargestellt. Das betrachtete Bild ist rauscharm wie ein Bild, das in 5 mm Dicke aufgenommen worden wäre, jedoch kann mit einem Inkrement von 1 mm geblättert werden. Außerdem kann die Schichtdicke jederzeit auf bis zu 1 mm verringert oder über 5 mm hinaus erhöht werden. Die Mittelung in der sts-Darstellung kann in manchen Nachverarbeitungsworkstations in Form einer Mittelung (klassische STS), als MIP, als Min-IP oder als VR (Volume Rendering = Raycasting) erfolgen. Ebenso ist bisweilen möglich, die Ansichten multiplanar reformatierter Bilder in sts-Darstellungen umzurechnen.[1]
-
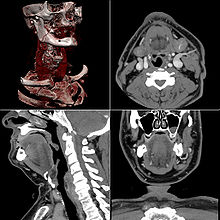
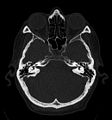
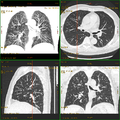
Craniale Computertomographie Abgebildet sind Felsenbein und Nasennebenhöhlen. Aufgrund der hohen Auflösung der Aufnahme des verwendeten 64-Zeilen-CTs sind selbst die Gehörknöchelchen erkennbar.
-
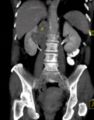
Kombination aus Multiplanarer Reformatierung und sliding thin slab. Der Bildkursor befindet sich in der Harnblase. Die Originalschichtdicke beträgt 1,25 mm, dargestellt wird in allen Ansichten gemittelt (=average) in 3,7 mm bzw. 3,8 mm Dicke.
-
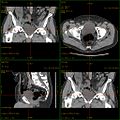
Kombination aus Multiplanarer Reformatierung und sliding thin slab. Der Bildkursor befindet sich im rechten Lungenflügel. Die sts-Bildstapel werden in Form von MIP-Darstellungen gezeigt (STS-MIP)[20]. Links oben befindet sich eine VR-Darstellung der Lunge; sie zeigt einen Blick auf die koronal an Kursorposition geschnittene Lunge.
-
CT-Angiographie; mittels multiplanarer Reformation (hier die sog. curved MPR)sind auch Schnittdarstellungen entlang beliebiger Gefässverläufe möglich, wodurch die gezeigte Arteriosklerose sehr gut visualisiert werden kann.
Strahlenexposition
Ein Nachteil der Computertomographie ist die Strahlenexposition. Vergleicht man eine CT-Aufnahme beispielsweise mit der natürlichen Strahlenbelastung, so führt eine typische Abdomenaufnahme zu einer Exposition, die 2,8 Jahren natürlicher Hintergrundstrahlung entspricht.[1] Obgleich dies ca. 1000-mal höher ist als bei einer Thorax-Röntgenaufnahme[21], ist es auch in diesem Dosisbereich statistisch nicht möglich, eine später auftretende Erkrankung mit hinreichender Sicherheit auf die vorangegangene Strahlenexposition zurückzuführen. Bis heute wird daher aus der Häufigkeit von Erkrankungen, die aus einer sehr viel höheren Strahlenbelastung resultierten, linear auf die zu erwartenden Fälle bei niedriger Strahlenbelastung extrapoliert,[22] obgleich für dieses angenommene Risiko keine belastbare Statistik vorliegt.[1] Denkbar - jedoch bis heute statistisch nicht belegbar - wären auch Hormesis-Effekte (also positive Effekte) bei geringen Strahlendosen. Es existieren eine Reihe von Studien, die in diese Richtung deuten.[23]
So lange es jedoch keine stichhaltigen Belege gibt, dass es bei geringen Strahlenbelastungen kein oder ein erheblich niedrigeres Risiko gibt als es bei hohen Strahlendosen zweifelsfrei existiert, muss dieses angenommene Risiko bei der Indikationsstellung berücksichtigt werden. Die hohe Aussagekraft der CT kann die Durchführung rechtfertigen. Ärzte unterschätzen laut Heyer die Strahlenbelastung bei der Computertomographie:[24] Diese machte im Jahr 2003 gut 6 % aller Röntgenuntersuchungen aus, war aber für mehr als 50 % der medizinischen Röntgenstrahlung verantwortlich.[25] Jährlich werden in den USA mehr als 62 Mio. CT-Scans durchgeführt. Jede dritte dieser Untersuchungen ist nach Experteneinschätzungen nicht notwendig.[26] Eine Übersichtsarbeit im „New England Journal of Medicine“ warnt, dass die jetzt durchgeführten CTs in einigen Jahrzehnten für 1,5–2 % aller Krebserkrankungen verantwortlich sein könnten. Die Autoren der Übersichtsarbeit stellten aber auch klar, dass in den etablierten Indikationen der Nutzen das Risiko überwiege.[27] Eine 2009 veröffentlichte Studie macht 70 Millionen CT-Scans in den USA für 29.000 Krebsfälle verantwortlich und berechnet die jährlichen CT-Todesfälle in den USA mit 14.500.[28]
Die Strahlenexposition durch eine CT-Aufnahme wird durch die Größen CTDI und DLP quantitativ beschrieben. Multipliziert man das CTDI mit der Länge des bestrahlten Bereiches, erhält man das DLP. Bei Kenntnis der bestrahlten Region kann man hieraus die Organdosen der betroffenen Organe und daraus wiederum die Effektive Dosis errechnen. Die folgende Tabelle zeigt die effektiven Dosen typischer Untersuchungen. Diese unterliegt jedoch einer starken Streuung.
Untersuchung Effektive Dosis (mSv) Röntgenaufnahme des Thorax 0,02[29] – 0,1 Natürliche Strahlenbelastung pro Jahr 2,1[30] Kopf-CT 1,5[31] – 2,3[29] Screening Mammografie 3 Abdomen-CT 5,3[31] – 10[29] Thorax-CT 5,8[31] – 8[29] Thorax-, Abdomen- und Pelvis-CT 9,9[31] Einflussparameter auf die Strahlenbelastung
Einer der wichtigsten Güteparameter für die Bildqualität eines CT ist das Bildrauschen, das zum größten Teil von Quantenrauschen im Detektor verursacht wird. Eine Verbesserung der Bildqualität ist mit Änderungen von Aufnahmeparametern verbunden, die meist zu einer Erhöhung der Strahlenbelastung des Patienten führen. Die Untersuchungsparameter sollen aus Strahlenschutzgründen so gewählt werden, dass der Rauschanteil im Bild ausreichend niedrig ist, dass eine sichere Befundung noch möglich ist. Es wird folglich auch hier gemäß dem ALARA-Prinzip nicht ein möglichst gutes, sondern nur ein hinreichend gutes Bild angestrebt.
Der Zusammenhang zwischen dem Bildrauschen σ, dem gewählten Rekonstruktionsalgorithmus fA, der Schwächung I0/I, der Systemeffizienz
 , dem Milliampere-Sekundenprodukt Q und der Schichtdicke S ist:[1]
, dem Milliampere-Sekundenprodukt Q und der Schichtdicke S ist:[1]
Aus dieser Gleichung ergibt sich unter anderem, dass sich bei Vervierfachung der Schwächung I0/I das Bildrauschen verdoppelt.
Vorfilterung der Röntgenstrahlung
Das Emissionsspektrum jeder Röntgenröhre enthält auch niederenergetische Strahlenanteile, die vollständig vom Untersuchungsobjekt absorbiert werden und damit nicht zur Bildgebung beitragen. Zur Verringerung der Strahlenbelastung wird daher ein Röntgenfilter aus mehrere Millimeter dickem Blech (z.B. aus Aluminium, Kupfer oder Beryllium) verbaut; eine Mindest-Vorfilterung ist seit Jahren sogar gesetzlich vorgeschrieben. Das Blech absorbiert die niederenergetischen Anteile des Röntgenspektrums vollständig.
Die Dosisleistung einer Röhre kann folglich nur dann mit den Angeben von Röhrenspannung und Röhrenstrom beschrieben werden, wenn neben dem Fokus-Objektabstand auch die Vorfilterung bekannt ist und in die Berechnung mit einbezogen wird.
Röhrenspannung
Eine Erhöhung der Röhrenspannung erhöht bei gleichem Röhrenstrom die Strahlenbelastung für den Patienten. In der klassischen Radiographie verringert dies auch den Bildkontrast, in der CT werden dagegen nur die Hounsfieldwerte dichter Knochenstrukturen etwas verringert, da der Bildkontrast rein durch die Wahl des Hounsfieldfensters bestimmt wird.
Photonen höherer Energie werden durch das Gewebe zwar geringer geschwächt als niederenergetische Photonen, jedoch steigt die insgesamt im Gewebe deponierte Energie stark an. Bei einer Röhren-Vorfilterung von 2 mm Kupfer beträgt die Äquivalentdosisleistungskonstante bei 100.000 Volt = 100 kV Röhrenspannung 0,2 - bei 140 kV Röhrenspannung jedoch schon ca. 1,6 [mSv*m²/mA*min].[32] Daraus folgt, dass eine Röntgenröhre bei 140 kV eine 8-fach höhere Dosisleistung liefert als bei 100 kV, wenn man den Röhrenstrom unverändert belässt.
Aus Strahlenschutzgründen wäre es folglich wünschenswert, mit niedrigen Röhrenspannungen um ca. 60-80 kV zu arbeiten, was jedoch nur selten möglich ist. Für die Bildgebung in der Computertomographie ist eine hohe Intensität (= Dosisleistung) der Röntgenstrahlung erforderlich. Die erforderliche Dosisleistung liegt bei Verwendung der leistungsfähigsten Drehanoden-Röhren leider auch heute noch im Allgemeinen höher, als mit dem höchsten einstellbaren Röhrenstrom bei einer Anodenspannung von beispielsweise 80 kV erzielt werden kann. Um ein ausreichend niedriges Bildrauschen zu gewährleisten, bleibt daher meist nichts anderes übrig, als die Röhrenspannung über den aus Strahlenschutzgründen optimalen Wert zu heben, denn der Wirkungsgrad einer Röntgenröhre steigt mit dem Quadrat der Röhrenspannung. Üblich sind Werte von ca. 120 kV, bei korpulenten Patienten auch 140 kV.
Röhrenstrom
Der Röhrenstrom verhält sich linear zur Dosis, d.h. eine Verdopplung des Röhrenstroms verdoppelt die Strahlenbelastung.
Rotationszeit
Ebenso verhält es sich mit der Rotationsdauer. Die beiden Parameter werden daher meist zusammengefasst. Angegeben wird das Produkt aus Rotationsdauer und Röhrenstrom in Milliampere-Sekunden, in der Gleichung oben abgekürzt mit Q und der Einheit mAs. Bei Halbierung der Rotationsdauer der Röhre muss folglich der Röhrenstrom verdoppelt werden, soll das Bildrauschen konstant bleiben.
Zusammenhang von Bildrauschen und Schichtdicke
Aus obiger Gleichung folgt ebenso, dass bei Halbierung der Schichtdicke (bei gleicher Rotationsdauer) der Röhrenstrom verdoppelt werden muss, soll das Bildrauschen konstant bleiben. Umgekehrt kann der Röhrenstrom halbiert werden, wenn die Schichtdicke verdoppelt wird. Um das Bildrauschen zu halbieren, muss der Röhrenstrom vervierfacht werden. Alternativ kann die Schichtdicke vervierfacht oder beides verdoppelt werden.
Pitch und Rekonstruktionsfilter
Die Strahlenbelastung wird auch wesentlich vom gewählten Pitchfaktor bestimmt. Der Zusammenhang ist linear: Wird der Pitchfaktor bei sonst gleichen Parametern verdoppelt, halbiert sich die Strahlenbelastung.
Im Parameter fA ist neben dem Pitchfaktor auch der Einfluss des für die Bildrekonstruktion verwendeten Faltungskerns der Radon-Transformation enthalten: Dieser kann glättend oder kontrastanhebend wirken. Neben dem Kontrast wird allerdings auch das Bildrauschen σ verstärkt. σ kann je nach Faltungskern um bis zu einen Faktor 5 differieren. Die Faltungskerne werden je nach Hersteller etwas unterschiedlich benannt. Glättende Kerne heißen smooth oder soft, der Standard-Kern meist standard, kontrastverstärkend sind bone, edge, lung, high oder ultrahigh. Durch Wahl eines geeigneten Faltungskerns kann das Bild für das zu befundende Gewebe mit optimaler Qualität berechnet werden und damit unnötige Strahlendosis vermieden werden
Möglichkeiten zur Verringerung der Strahlenexposition
Die Strahlenbelastung des Patienten kann durch eine Reihe von Maßnahmen gesenkt werden. Eine aus strahlenschutzgründen wünschenswerte Dosisersparnis bedeutet auch eine Verringerung der Röhrenbelastung, was letztlich die Lebensdauer der Röhre erhöht. Da CT-Röhren höhere 5-stellige Beträge kosten, ist hiermit ein weiterer Anreiz zur Dosissenkung geschaffen - zumindest für den niedergelassenen Radiologen, der die Kosten für einen Röhrentausch selbst zu tragen hat.
Untersuchungsbereich und medizinisches Aufnahmeprotokoll
Allen voran ist natürlich der Radiologe in der Pflicht, der die Zahl der CT-Untersuchungen auf die tatsächlich klar indizierte Fälle begrenzen muss. Jede zusätzliche Aufnahme bedeutet eine zusätzliche Strahlenbelastung und allzu oft werden mehrere Aufnahmen (nativ, arterielle Kontrastmittel-Phase, venöse Kontrastmittel-Phase, Spätphase) über dieselbe Untersuchungsregion gefahren. Auch mit der Begrenzung des Scan-Bereiches auf die relevante Untersuchungsregion kann einfach und effizient die Dosis reduziert werden.
technisches Aufnahmeprotokoll
Die MTRA hat mit der Wahl des korrekten Untersuchungsprotokolls mit auf die Fragestellung optimierter Schichtdicke, Pitchfaktor, Faltungskern und Bildrauschen eine weitere, sehr mächtige Möglichkeit zur Dosisersparnis. Bei schlanken Patienten und Kindern kann und soll in aus Strahlenschutzgründen optimalen Röhrenspannungsbereichen von 60 bis 100 kV gearbeitet werden.
Dosismodulation
CTs aller großen Hersteller verfügen heute über eine Dosismodulation. Der Röhrenstrom wird dabei der vorliegenden Schwächung angepasst, sowohl in x-y wie auch in Z-Richtung. Dies bedeutet, dass bei Aufnahme der Lunge, die Leistung im Vergleich zum Abdomen zurückgenommen wird. Aber auch bei der Rotation wird der Röhrenstrom moduliert. Da der menschliche Körper einen näherungsweise ovalen Querschnitt hat, wird die Röhrenlast diesem Umstand angepasst. Die Leistung wird zurückgenommen, wenn von vorne bzw. von hinten (aus Sicht des Patienten) gestrahlt wird und hochgeregelt, wenn von der Seite gestrahlt wird. Meist ist diese Dosisregelung mit einer zweiten Automatik kombiniert, die den Röhrenstrom auch in Abhängigkeit vom Body-Mass-Index des Patienten regelt. Die Hersteller benutzen unterschiedliche Namen für diese Funktionen, z.B. Auto-mA, Smart-mA, Caredose 4D, Doseright oder Sure-Exposure.[33]
Schichtdicke
Werden mehrere Schichten summiert dargestellt, verringert dies zwar die Auflösung im Bild, jedoch auch das Bildrauschen. Verzichtet der Arzt auf eine hohe Auflösung, weil er den Befund auch in einer Darstellung mit beispielsweise 5 mm Schichtdicke hinreichend gut erkennen kann, kann durch Wahl eines darauf abgestimmten Aufnahmeprotokolls signifikant Dosis eingespart werden. Die Verwendung der „Sliding thin slap“-Darstellung kann damit letztendlich auch zur Dosissenkung beitragen.
Alternativen
Im Jahre 1977 wurden die ersten Studien zur Magnetresonanztomographie, abgekürzt MRT, am Menschen publiziert.[34]
Dieses, auch Kernspintomographie bezeichnete Verfahren, bot zwei große Vorteile:
1. Es wird keine potentiell krebserregende Röntgenstrahlung verwendet.
2. Organe und Gewebe können auch ohne Verwendung von Kontrastmittel mit hohem Weichteilkontrast abgebildet werden, was insbesondere bei Patienten mit eingeschränkter Nierenfunktion ein gewichtiges Argument darstellt. Der Weichteilkontrast ist sogar deutlich besser als bei den modernsten Computertomographen.
Nachteilig waren lange Zeit die schlechtere Verfügbarkeit bedingt durch den höheren Anschaffungspreis der MRT-Geräte. Das starke Magnetfeld, die räumliche Enge im Gerät und die im Vergleich zur CT auch heute noch lange Untersuchungszeit bringen weitere Einschränkungen mit sich: So können zum Beispiel intensivmedizinisch überwachungspflichtige Patienten, Patienten mit Klaustrophobie oder Patienten die z.B. schmerzbedingt nicht für eine längere Zeit ruhig liegen können, nur eingeschränkt im MRT untersucht werden. Die erheblich längere Untersuchungszeit ist auch im Hinblick auf Unschärfe durch physiologische Patientenbewegung (Herz, Lunge, Darm) bis heute ein relevanter Nachteil. Außerdem ist die MRT zwar in der Lage, Weichteile mit exzellentem Weichteilkontrast darzustellen, aber prinzipbedingt bei der Darstellung von Knochen und Zähnen im Nachteil. Die MRT stellt damit oftmals keine Alternative, sondern ein komplementäres Verfahren dar.
Im zahnärztlichen Bereich ist eine alternative Bildgebung die Digitale Volumentomographie (= DVT). Für Angiographie-Anlagen und C-Bögen sind bisweilen Softwareoptionen verfügbar, die in Form der Rotationsangiographie ebenso eine räumliche Darstellung ermöglichen. In DVT wie auch in der Rotationsangiographie werden ähnliche Algorithmen wie bei der CT zur Bildberechnung verwendet.
Weblinks
 Commons: Computertomographie – Sammlung von Bildern, Videos und Audiodateien
Commons: Computertomographie – Sammlung von Bildern, Videos und Audiodateien Commons: Computertomographiegeräte – Sammlung von Bildern, Videos und Audiodateien
Commons: Computertomographiegeräte – Sammlung von Bildern, Videos und Audiodateien Wiktionary: Computertomografie – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: Computertomografie – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen- Computertomographie - CT Cases.net
- Erklärung der Computer-Tomographie bei netdoktor.de
- Schattenspiele: CT-Erklärung für Kinder
- Gefährliche Strahlenbelastung
- Fernbedienbares optisches Modellexperiment zur Computertomographie (siehe dort unter „Labs“)
- Seminararbeit zu Computertomographie (gut & anschaulich erklärt) (PDF; 1,15 MB)
Einzelnachweise
- ↑ a b c d e f g h i j k l m n o p q r s t u Kalender W. A.: Computertomographie. Grundlagen, Gerätetechnologie, Bildqualität, Anwendungen Mit Mehrschicht-Spiral-CT. Publicis MCD Werbeagentur München 2000; ISBN 3-89578-082-0.
- ↑ Buzug T.M.: Einführung in die Computertomographie: Mathematisch-physikalische Grundlagen der Bildrekonstruktion. Springer, Berlin Heidelberg New York 2002, ISBN 3-540-20808-9 (google books).
- ↑ Kalender W. A.: Computertomographie. Grundlagen, Gerätetechnologie, Bildqualität, Anwendungen. 2., überarb. und erw. Auflage. Publicis Corporate Publishing, Erlangen 2006; ISBN 3-89578-215-7.
- ↑ Allen M.Cormack: My Connection with the Radon Transform, in: 75 Years of Radon Transform, S. Gindikin and P. Michor, eds., International Press Incorporated (1994), pp. 32 - 35, ISBN 1-57146-008-X
- ↑ a b Philip Gabriel: Experimentelle Studie zum Vergleich der Bildqualität von axialen Schnittbildern und multiplanaren Reformationen der Computertomographie anhand von Wirbelkörperpräparaten. In: Inaugural– Dissertation zur Erlangung des Medizinischen Doktorgrades. Medizinische Fakultät der Albert–Ludwigs–Universität Freiburg im Breisgau, 2004, abgerufen am 24.April 2009 (PDF, deutsch).
- ↑ National Museum of American History ACTA Model 0100 CT Scanner
- ↑ GE Healthcare Product Features: eSpeed. GE Healthcare, 2009, abgerufen am 24.April 2009 (englisch).
- ↑ Info auf www.allbusiness.com
- ↑ Website von Toshiba
- ↑ Siemens AG - Erster Dual-Source-Computertomograph der Welt. 17. November 2005, abgerufen am 30. Januar 2008.
- ↑ Gabriele Wagner: CT mit Doppel-Röhre: schneller, schärfer - und die Strahlendosis sinkt. Ärzte Zeitung online, 30. November 2006, abgerufen am 30. Januar 2008.
- ↑ Biomedizinische Technik/Biomedical Engineering. Band 30, Heft s1, Seiten 189–190, ISSN (Online) 1862-278X, ISSN (Print) 0013-5585, DOI: 10.1515/bmte.1985.30.s1.189, //1985: Anwendung der zwei Spektren-CT zur Bestimmung der Knochenmineralisierung am Wirbelkörper
- ↑ Website von Siemens Healthcare
- ↑ Auntminnie News
- ↑ a b Iterative Image Reconstruction Method (ASIR): Lowering CT Radiation Dose and Improving Image Quality Radiology Rounds Online
- ↑ GE Healthcare
- ↑ Toshiba Medical Systems Aquiliion ONE
- ↑ Iterative reconstruction slahes radiation dose Online bei Diagnostic Imaging.com
- ↑ http://www.aerzteblatt.de/nachrichten/44512/MRT_laut_Barmer_Arztreport_in_Deutschland_am_haeufigsten.htm
- ↑ STS-MIP: A new Reconstruction technicque for the CT of the chest [1] Journal of computer assisted tomography
- ↑ Experten warnen vor Computertomografie
- ↑ ICRP 60 von 1990
- ↑ Luckey, T.D.: Physiological benefits from low levels of ionization radiation. Health physics 1982; 43 (6):771-789
- ↑ Schöne Bilder verlocken zu unnötigen Untersuchungen
- ↑ RöFo, 2007, 179 (3): 261-7 zitiert nach „Der Allgemeinarzt“ 8/2007, S. 18
- ↑ Warnung vor Vorsorge-CT
- ↑ N Engl J Med 2007;357:2277-84
- ↑ Berrington de González A, Mahesh M, Kim KP, et al.: Projected cancer risks from computed tomographic scans performed in the United States in 2007. In: Archives of Internal Medicine. 169, Nr. 22, Dezember 2009, S. 2071–2077. doi:10.1001/archinternmed.2009.440. PMID 20008689. Abgerufen am 23. März 2010.
- ↑ a b c d Orientierungshilfe für radiologische und nuklearmedizinische Untersuchungen. Empfehlung der Strahlenschutzkommission. Bonn 2006 ISBN 3-87344-130-6 PDF 850 kB
- ↑ Umweltradioaktivität und Strahlenbelastung im Jahr 2006 – Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit
- ↑ a b c d Shrimpton, P.C; Miller, H.C; Lewis, M.A; Dunn, M. Doses from Computed Tomography (CT) examinations in the UK - 2003 Review
- ↑ Krieger / Petzold: Strahlenphysik, Dosimetrie und Strahlenschutz, Band 1 Grundlagen; B.G. Teubner Stuttgart 1992
- ↑ Radiographics Radiation Dose Modulation Techniques in the Multidetector CT Era: From Basics to Practice
- ↑ Damadian R, Goldsmith M, Minkoff L: NMR in cancer: XVI. Fonar image of the live human body. In: Physiological Chemistry and Physics. 9, 1977, S. 97–100.
Wikimedia Foundation.