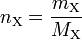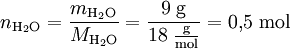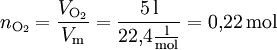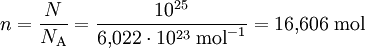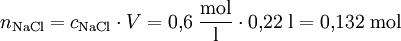- Molmenge
-
Physikalische Größe Name Stoffmenge Formelzeichen der Größe n Formelzeichen der Dimension N Größen- und
Einheiten-
systemEinheit Dimension SI Mol (mol) N Mit Stoffmenge wird die quantitative Menge für Stoffe, insbesondere in der Stöchiometrie, bezeichnet. Diese Stoffmenge ist dabei weder Masse, noch Teilchenzahl, sondern im Internationalen Einheitensystem (SI) durch willkürliche Vereinbarung als Basisgröße eigener Art festgelegt. Das bedeutet, sie ist auch nicht durch andere SI-Basisgrößen darstellbar. Die Einheit der Stoffmenge ist das Mol, eine SI-Basiseinheit.
Bei Verwendung des Mols muss die zugrunde gelegte Anzahl der Teilchen (insbesondere Atome und Moleküle) genau festgelegt werden; ein Mol eines Stoffes enthält etwa 6,02214179(30)·1023 [1] solcher Teilchen (Avogadro-Zahl NA, auch Loschmidt-Zahl). Diese Teilchen können auch gedachte Bruchstücke realer Teilchen (z. B. 1/4 eines Moleküls oder Ions) – so genannte Äquivalentteilchen oder kurz Äquivalente – sein, so dass die veraltete Einheit Val für Äquivalentgewichte ohne Änderungen an vertrauten Zahlenwerten durch das Mol ersetzt werden kann. Viele Einzelheiten hierzu stehen in der deutschen Norm DIN 32 625.
Für die Stoffmenge nX und die Masse mX einer Stoffportion eines Reinstoffes X und dessen molare Masse MX gilt folgender Zusammenhang:
Berechnung der Stoffmenge
Die Berechnung der Stoffmenge erfolgt
- ... aus der Masse:
Die Berechnung aus der Masse ist über die oben angegebene Gleichung möglich.
Beispiel: Die molare Masse von Wasser beträgt 18 Gramm pro Mol. 9 Gramm Wasser entsprechen damit einer Stoffmenge von 0,5 Mol.
- ...aus dem Volumen:
Bei Gasen lässt sich verhältnismäßig leicht die Stoffmenge aus dem Volumen bestimmen, da ein Mol eines beliebigen Gases bei Normalbedingungen in Näherung ein Volumen von 22,4 Litern einnimmt. Dieses Volumen bezeichnet man als molares Normvolumen (Molvolumen): Vm = 22,4 l/mol.
Beispiel: Wie viel Mol entsprechen 5 l Sauerstoff-Molekülen O2?
- ... aus der Teilchenzahl:
Da ein Mol einer Teilchenanzahl von ca. 6,022 · 1023 (Avogadrozahl NA) entspricht, kann man aus der Anzahl der Teilchen die Stoffmenge berechnen.
Beispiel: Gegeben sind N = 1025 Teilchen.
- ...aus der Molarität:
Da die Molarität cX (mol/l) ein Konzentrationsmaß für Lösungen darstellt, das die Stoffmenge eines Stoffes X in Beziehung zum Volumen V der Lösung stellt, kann man diese auch auf die Stoffmenge zurückrechnen.
Beispiel: Wie viel Mol Natriumchlorid befinden sich in 0,22 Liter einer 0,6 molaren NaCl-Lösung?
Quelle
- ↑ CODATA (2006): Avogadro constant, NIST.
Siehe auch
Wikimedia Foundation.