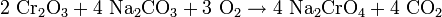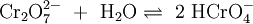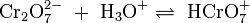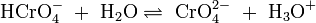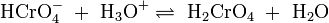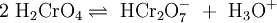- Na2Cr2O7
-
Strukturformel 

Allgemeines Name Natriumdichromat Andere Namen - Rotes chromsaures Natrium
- Doppeltchromsaures Natrium
- Natriumpyrochromat
- Natriumbichromat
Summenformel Cr2Na2O7 CAS-Nummer - 10588-01-9
- 7789-12-0 (Dihydrat)
Kurzbeschreibung orangerote, geruchlose, hygroskopische Kristallnadeln[1] Eigenschaften Molare Masse 261,97 g/mol Aggregatzustand fest
Dichte 2,52 g·cm−3 [1]
Schmelzpunkt 356,7 °C [1]
Siedepunkt 400 °C (Zersetzung) [1]
Löslichkeit leicht löslich in Wasser (2355 g/l bei 20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Brand-
förderndSehr giftig Umwelt-
gefährlich(O) (T+) (N) R- und S-Sätze R: 45-46-60-61-8-21-25-26-34-42/43-48/23-50/53 S: 53-45-60-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumdichromat(VI) (Na2Cr2O7) ist ein Natriumsalz der Dichromsäure (H2Cr2O7) und zählt zu den Chromaten. Es kristallisiert auch als Dihydrat (Na2Cr2O7 · 2 H2O, molare Masse 279,98 g/mol).
Inhaltsverzeichnis
Gewinnung und Darstellung
Natriumdichromat wird im großen Maßstab aus Erzen mit Chrom(III)-oxiden gewonnen. Das Erz wird mit Basen (in der Regel Natriumcarbonat) bei hohen Temperaturen in Anwesenheit von Sauerstoff behandelt:
Reaktionen in wässriger Lösung
Die wässrige Lösung reagiert sauer und es stellt sich ein Dichromat-Chromat-Gleichgewicht ein. Da das Chromat-Anion (CrO42−) eine starke Base ist, liegt das Anion zum großen Teil als Hydrogenchromat (HCrO4−) vor:
Da durch die Autoprotolyse des Wassers immer OH−-Ionen und H+-Ionen (bzw. H3O+-Ionen) vorhanden sind stellen sich weitere Gleichgewichtsreaktionen ein:
Verwendung
Es findet häufige Verwendung in der Metalloberflächenbehandlung (Korrosionsinhibitor), zur Holz-Imprägnierung und unter Anderem zur Herstellung von Korrosionsschutzpigmenten verwendet[3], wobei ein Gleichgewicht aus Natriumdichromat und Natriumchromat gebildet wird. Weiterhin wird es in der chemischen Industrie als Oxidationsmittel für organische Syntheseprozesse verwendet, beispielsweise zur Synthese von Anthrachinon.[4]
Sicherheitshinweise
Natriumdichromat ist sehr giftig, brandfördernd und umweltgefährlich.[2] Es kann Krebs erzeugen, vererbbare Schäden verursachen, die Fortpflanzungfähigkeit beeinflussen und das Kind im Mutterleib schädigen.[1] Vor der Arbeit mit Natriumdichromat sollte auf jeden Fall das Sicherheitsdatenblatt zu Rate gezogen und alle erforderlichen Vorsichtsmaßnahmen getroffen werden.
Einzelnachweise
- ↑ a b c d e f Eintrag zu Natriumdichromat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 9. November 2007 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 10588-01-9 im European chemical Substances Information System ESIS
- ↑ Patent DE 2707486C2
- ↑ Skript Uni Mainz
Wikimedia Foundation.