- Anthrachinon
-
Strukturformel 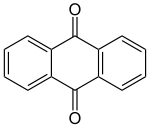
Allgemeines Name Anthrachinon Andere Namen 9,10-Dihydro-anthracen-9,10-dion
Summenformel C14H8O2 CAS-Nummer 84-65-1 PubChem 6780 Kurzbeschreibung rhombische, schwach gelblich-grüne, geruchlose Nadeln[1]
Eigenschaften Molare Masse 208,22 g·mol−1 Aggregatzustand fest
Dichte 1,44 g·cm−3[2]
Schmelzpunkt Siedepunkt 380 °C[2]
Dampfdruck Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze [2] EU-Gefahrstoffkennzeichnung [3] 
Reizend (Xi) R- und S-Sätze R: 43 S: 36/37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Anthrachinon ist ein vom Anthracen abgeleitetes Chinon. Es wurde erstmals 1836 von Auguste Laurent durch Oxidation von Anthracen hergestellt.
Inhaltsverzeichnis
Vorkommen
Anthrachinon kommt in Form des seltenen Minerals Hoelit in der Natur vor.[4] Anthrachinonderivate sind die Wirkstoffe diverser pflanzlicher Abführmittel: Rhabarberwurzel, Faulbaumrinde, Kap-Aloe, Sennesblätter, und Kreuzdornbeeren.
Gewinnung und Darstellung
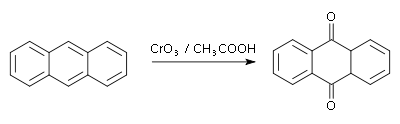
Anthrachinon lässt sich durch die Oxidation von Anthracen mit Salpetersäure oder Chromsäure herstellen.[5]
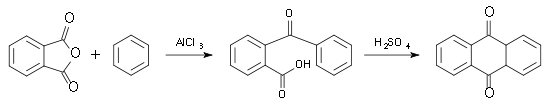
Günstiger ist jedoch die Reaktion von Benzol und Phthalsäureanhydrid nach Friedel-Crafts. Dabei entsteht zunächst eine Oxocarbonsäure, die sich dann mit Schwefelsäure zum Anthrachinon weiter umsetzen lässt.[6]
Eigenschaften
Anders als die meisten Chinone ist Anthrachinon nicht wasserdampfflüchtig. Gegenüber Oxidationsmitteln ist Anthrachinon recht unempfindlich, durch Reduktionsmittel jedoch leicht in Anthrahydrochinon bzw. Anthron überführbar. Diese Reduktionsfähigkeit bildet die Grundlage für die Verknüpfung von Anthrachinonen zu Dianthronen und Polyanthronen. Durch Einführung von funktionellen Gruppen in das Molekül (z. B. Hydroxyl- und Aminofunktionen), vor allem in den Positionen 1, 4, 5 oder 8, erhöht sich die Farbintensität und verändert sich die Farbe. Sie kann von gelb bis violett gezielt variiert werden.
Verwendung
Anthrachinon ist ein wichtiger Grundstoff für die Herstellung von Anthrachinonfarbstoffen, zum Beispiel Alizarin. 2-Alkylanthrachinone (z. B. 2-Ethylanthrachinon) dienen bei der technischen Herstellung von Wasserstoffperoxid nach dem Anthrachinon-Verfahren als Katalysator. Des Weiteren wird es als Vogelabschreckmittel verwendet.
Einzelnachweise
- ↑ a b c Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c d e f g Eintrag zu CAS-Nr. 84-65-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2008 (JavaScript erforderlich).
- ↑ G. Hommel: Handbuch der gefährlichen Güter. Transport - Gefahrenklassen, Merkblatt 1287, 2002, Springer-Verlag, ISBN 3-540-20348-6.
- ↑ Hoelite bei mindat.org (engl.).
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 383.
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 340.
Siehe auch
- Anthrachinone als Wirkstoffgruppe in der Pflanzenheilkunde
Weblinks
Kategorien:- Reizender Stoff
- Sensibilisierender Stoff
- Anthrachinon
Wikimedia Foundation.