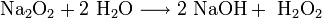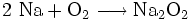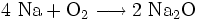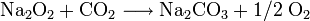- Na2O2
-
Kristallstruktur 
Allgemeines Name Natriumperoxid Verhältnisformel Na2O2 CAS-Nummer 1313-60-6 Kurzbeschreibung gelbliches Pulver[1] Eigenschaften Molare Masse 77,98 g/mol Aggregatzustand fest[1]
Dichte Schmelzpunkt Siedepunkt 657 °C (Zersetzung)[1]
Löslichkeit Zersetzung in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Brand-
förderndÄtzend (O) (C) R- und S-Sätze R: 8-35 S: (1/2)-8-27-39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumperoxid das Peroxid des Natriums. Es besitzt die Summenformel Na2O2.
Inhaltsverzeichnis
Eigenschaften
Natriumperoxid ist ein gelbliches Pulver. Es hat die für Peroxide typischen Eigenschaften, ist ein starkes Oxidationsmittel und sehr instabil. Mit Wasser reagiert es zu Natriumhydroxid und Wasserstoffperoxid.
Herstellung
Großindustriell wird es durch Verbrennung von Natrium in Sauerstoffatmosphäre gewonnen:
Da bei der Verbrennung von Natrium in Sauerstoffatmosphäre auch Natriumoxid entsteht,
muss dieses noch vom Natriumperoxid getrennt werden. Um einen höheren Anteil an Natriumperoxid zu erhalten, wird die Temperatur bei 300–400 °C gehalten. Hierdurch wird die Bildung von Natriumoxid vermindert.[3]
Verwendung
In der Industrie wird Natriumperoxid als Oxidations- und Bleichmittel verwendet. Es findet unter Anderem zur CO2-Absorption (z. B. in Atemschutzgeräten oder U-Booten zur „Luftaufbereitung“) und Sauerstoffproduktion Verwendung:
Im Anionentrennungsgang kann Natriumperoxid anstelle der Mischung Natronlauge/Wasserstoffperoxid zum alkalischem Sturz verwendet werden.[4]
Quellen
- ↑ a b c d e f Eintrag zu CAS-Nr. 1313-60-6 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 18. Dezember 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 1313-60-6 im European chemical Substances Information System ESIS
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage, Gruyter Verlag, 1995, S. 1175
- ↑ Jander, Blasius: Lehrbuch der analytischen und präparativen Anorganischen Chemie, 14. Auflage, S. 561–567, S. Hirzel Verlag, Stuttgart 1995, ISBN 3-7776-0612-X.
Wikimedia Foundation.