- Neutrophiler Granulozyt
-
 Stabkerniger (junger) neutrophiler Granulozyt
Stabkerniger (junger) neutrophiler Granulozyt
 Segmentkerniger (reifer) neutrophiler Granulozyt
Segmentkerniger (reifer) neutrophiler Granulozyt
Die neutrophilen Granulozyten, auch kurz Neutrophile genannt, sind mit einem Anteil von 50–65 % die häufigsten weißen Blutkörperchen (Leukozyten). Als Phagozyten („Fresszellen“) sind sie Teil der angeborenen Immunabwehr und dienen der Identifizierung und Zerstörung von Mikroorganismen.
Inhaltsverzeichnis
Struktur
Neutrophile sind kugelförmige Zellen mit einem Durchmesser von 12 bis 15 µm (Mikrometer). Charakteristisch für ausgereifte Neutrophile ist der aus drei bis fünf Segmenten bestehende Kern. Das Cytoplasma von Neutrophilen enthält zwei Arten von Granula: Die „spezifischen“ Granula, die auch als sekundäre Granula bezeichnet werden, enthalten Enzyme wie Lysozym, Kollagenase, Elastase, Plasminogenaktivatoren, Neuramidase und Cathepsin G. Diese Granula lassen sich nicht mit basischen und sauren Farbstoffen färben, was sie ebenfalls in namensgebender Weise von Basophilen und Eosinophilen unterscheidet. Die „azurophilen“ Granula entsprechen den Lysosomen und werden auch primäre oder unspezifische Granula genannt. Sie enthalten, neben Bestandteilen wie sauren Hydrolasen und antimikrobiellen Enzymen, auch Substanzen wie Defensine, Myeloperoxidase, Cathelicidine und Laktoferrin, wodurch sie wirksam gegen einige Bakterien, Viren und Pilze vorgehen können.
Reifung
Ein erwachsener Mensch produziert mehr als 1011 Neutrophile pro Tag. Sie werden im Knochenmark gebildet. Junge Neutrophile weisen einen stabförmigen Kern auf, weshalb sie als Stabkernige bezeichnet werden, analog dazu werden ausgereifte Neutrophile mit ihren drei bis fünf Kernsegmenten als Segmentkernige bezeichnet. Sollten Neutrophile innerhalb von 6 - 8 Stunden nach Eintritt in die Blutbahn nicht in Kontakt mit Infektionen und/oder Entzündungsreaktionen kommen, verlassen sie die Blutbahn, erfahren einen programmierten Zelltod (Apoptose) und werden durch Makrophagen in Leber oder Milz abgebaut. Neutrophile haben im allgemeinen eine Lebensdauer von 1 - 4 Tagen.
Funktion
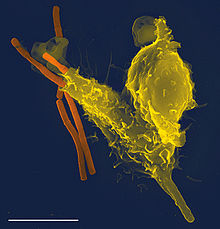 Eine REM-Aufnahme eines neutrophilen Granulozyten (gelb) beim Aufnehmen von Anthrax-Bakterien (orange); der weiße Strich unten links entspricht 5µm.
Eine REM-Aufnahme eines neutrophilen Granulozyten (gelb) beim Aufnehmen von Anthrax-Bakterien (orange); der weiße Strich unten links entspricht 5µm.
Neutrophile zirkulieren im Blut und wandern im Falle einer Infektion zum Ort des Geschehens. Dies gilt in gleichem Maße für Monozyten. Dort nehmen sie die infektionsauslösenden Mikroben auf und verdauen sie. Um infiziertes und/oder entzündetes Gewebe zu erreichen, verlassen beide in einem durch Adhäsionsmoleküle und Chemokine (lösliche „Lockstoffe“) vermittelten mehrstufigen Prozess den Blutstrom und dessen Gefäße. Dabei wandern sie durch die Interzellular-Räume der endothelialen Zellen in postkapillaren Venolen. Der Vorgang der Rekrutierung von Neutrophilen und Monozyten zum Infektionsherd lässt sich in vier Schritte unterteilen:
- Selectin-vermitteltes „Entlang“-Rollen am Gefäß-Endothelium: Makrophagen, die vor Ort Mikroben verdaut haben, schütten Cytokine wie Interleukin-1 (IL-1) und Tumornekrosefaktor (TNF) aus. Diese induzieren bei in der Nähe liegenden Epithelzellen die Zunahme von Selectinen (P-Selectin und E-Selectin) auf der Oberfläche. Neutrophile und Monozyten besitzen auf ihrer Oberfläche das L-Selectin als Adhäsionsmolekül und die für P- und E-Selectin spezifischen Kohlenhydrat-Liganden. Die entstehenden Selectin-Selectin-Interaktionen sind sehr schwach und werden durch die Scherkräfte des Blutstroms unterbrochen. Das führt zu einem langsameren „Entlang“-Rollen von Neutrophilen und Monozyten auf dem Endothelium, indem sie sich permanent an die Oberfläche binden und wieder lösen.
- Chemokin-vermittelte Verstärkung der Integrin-Affinität: Ausgeschüttete Cytokine wie IL-1 und TNF induzieren in Makrophagen, endothelialen und anderen Zell-Typen die Produktion von Chemokinen. Sie werden an der Oberfläche des Epithel-Lumen gebunden und dadurch konzentriert. „Vorbei“-rollende Neutrophile und Makrophagen erkennen diese mit spezifischen Chemokin-Rezeptoren. Dies führt dazu, dass Integrine auf deren Oberfläche von einer geringen Affinität zu einer hohen Affinität wechseln. Zusätzlich lagern sich diese Integrine zusammen und führen zu einer stärkeren Bindung an die Endothel-Oberfläche und ein verlangsamtes „Rollen“.
- Stabile Integrin-vermittelte Adhäsion an das Endothelium: Parallel zur Integrin-Affinitätsänderung auf Neutrophilen und Monozyten werden auf deren Zelloberfläche Liganden wie VCAM-1 (engl. vascular cell adhesion molecule-1) und ICAM-1 (engl. intercellular adhesion molecule-1) exprimiert, die an Integrine des Endothels binden. Auch diese Liganden-Produktion wird durch Chemokine induziert. Zusammen mit den in 2. beschriebenen Effekten führt dies zu einer festen Bindung an das Endothelium. Hierdurch finden Umlagerungen des Cytoskeletts statt und die Leukozyten positionieren sich abgeflacht auf dem Endothelium.
- Durchwanderung des endothelialen Gewebes: Neutrophile und Monozyten folgen nun den Konzentrationsgradienten der lokalen Chemokine und wandern zwischen den endothelialen Zellen zum infizierten Gewebe. Für diesen Vorgang werden Teile der extrazellulären Matrix (EZM) der Endothelzellen aufgelöst, um genügend Freiraum für die durchwandernden Leukozyten zu bieten. Diese schütten hierfür ihre spezifischen Granula aus, deren Proteasen die Auflösung ermöglichen.
Durch diese Prozesse akkumulieren Neutrophile und Monozyten am Infektionsort, wodurch die Hauptkomponente einer Entzündung gegeben ist. Durch zeitliche Unterschiede der induzierten Chemokin-Rezeptor- und Integrin-Expression werden innerhalb von Stunden bis Tagen zuerst Neutrophile zum Infektionsort rekrutiert, innerhalb von Tagen bis Wochen erst Monozyten. Bei einer Infektion steigt im Blut die Konzentration von Neutrophilen an (Neutrophilie), was durch eine Zunahme von „Stabkernigen“ (ein Merkmal junger Neutrophiler) eine gesteigerte Neubildung beweist. Am Infektionsort angekommen, werden Mikroben durch Neutrophile und Makrophagen aufgenommen und zerstört, ein Prozess, der Phagozytose genannt wird.
Neutrophile Granulozyten haben zudem die Fähigkeit, Bakterien mittels einer freigesetzten fibrillären Matrix aus Granula-Proteinen und Chromatin zu binden. Dies verhindert einerseits die weitere Verbreitung von Bakterien und fördert andererseits das Zerstören der dort festgesetzten Bakterien. [1] Diese Netze werden engl. „Neutrophil Extracellular Traps“ (NETs) bezeichnet. Dieser Vorgang wird in Anlehnung an die beiden anderen Zelltodarten Nekrose und Apoptose in der deutschen Literatur zunehmend als Netose bezeichnet[2] und stellt somit eine der 3 Formen des Zelltodes dar. Bakterien, die DNAse produzieren, können sich dem Abwehrmechanismus durch schneiden der fibrillären Matrix entsprechend entziehen.
Primäre Erkrankungen
Die septische Granulomatose führt trotz einer funktionsfähigen Wanderung zum Infektionsort und der Aufnahme von Mikroben bei Neutrophilen zu einem Defekt im Abbau, dem „Verdau“. Somit stehen Neutrophile als Teil der Immunantwort nicht mehr zur Verfügung, wodurch Infektionen einen kritischen Verlauf nehmen können.
Einzelnachweise
- ↑ V. Brinkmann, U. Reichard, C. Goosmann, B. Fauler, Y. Uhlemann, D.S. Weiss, Y. Weinrauch, A. Zychlinsky: Neutrophil extracellular traps kill bacteria. in: Science. 303.2004, 5663(5.März), 1532-1535. PMID 15001782 ISSN 0036-8075
- ↑ http://www.charite-ppi.de/fileadmin/Dokumente/vw2/FR_11.50_WahnV.pdf
Literatur
- Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai: Cellular and Molecular Immunology. 6. Auflage. Saunders Elsevier, Philadelphia 2007. ISBN 0-7216-0008-5
Weblinks
 Commons: Neutrophile Granulozyten – Sammlung von Bildern, Videos und Audiodateien
Commons: Neutrophile Granulozyten – Sammlung von Bildern, Videos und Audiodateien- Massberg, S. et al: Reciprocal coupling of coagulation and innate immunity via neutrophil serine proteases. In: Nature Medicine 16, 887 - 96 (2010). Nature PG, 1. August 2010, abgerufen am 6. August 2010 (englisch): „also implicated in thrombotic processes“ doi:10.1038/nm.2184
- The inner Life of the Cell. The President and the Fellows at Harvard University, 2007, abgerufen am 9. August 2010 (englisch, Animation u.a. zur Funktion des "Rollens" von Neutrophilen Granulozyten).
Wikimedia Foundation.
