- Nitrosylverbindungen
-
Nitrosyl ist ein Namensteil chemischer Verbindungen, die NO+- oder NO−-Ionen enthalten, für erstere ist die Bezeichnung üblicher. Die Verbindungen leiten sich vom Stickstoffmonoxid NO ab.
Die Reduktion von Stickstoffmonoxid ergibt das bei Temperaturen über −95 °C instabile Hyponitrit-Anion NO−:
- NO + e− → NO−
Bei der recht leicht erfolgenden Oxidation von NO entsteht das Nitrosyl- oder Nitrosonium-Kation NO+:
- NO → NO+ + e−
Beispiele für Nitrosylverbindungen sind:
- Nitrosylhalogenide
- Nitrosylfluorid NOF
- Nitrosylchlorid NOCl
- Nitrosylbromid NOBr
- Andere
- Schwarzes Roussin’sches Ammoniumsalz NH4[Fe4S3(NO)7]
- Nitrosylschwefelsäure/Nitrosylhydrogensulfat NOHSO4
- Nitrosyltetrafluoroborat [NO]BF4
- Nitrosylcyanid NOCN
- Nitrosylazid NON3
- Nitrosylperchlorat NOClO4
- Nitrosyltricarbonyltriphenyl-phosphinmangan C21H15MnNO4P
- Nitrosyl-tris-(triphenylphoshin)-rhodium [(C6H5)3P]3Rh(NO)
- Nitrosylhexafluorophosphat NOPF6
- Nitrosobenzol C6H5NO
Nitrosylsalze reagieren mit Wasser zu Salpetriger Säure
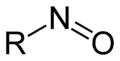
Organische Verbindungen der allgemeinen Form R1R2R3C-N=O, die sich formal vom NO−-Ion ableiten, werden als Nitrosoverbindungen bezeichnet. Gemeinsames Merkmal dieser Verbindungen ist die NO-Gruppe, die als funktionelle Gruppe Nitrosogruppe genannt wird.
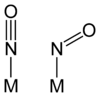
Tritt NO (also Stickstoffmonoxid) neutral oder als Anion oder Kation als Ligand in Komplexverbindungen auf, so werden diese manchmal als Metall-Nitrosyl-Komplexe bezeichnet. Das Nitrosyl-Ion ist isoelektronisch zu CO, N2 oder CN−, besitzt den Bindungsgrad 3 und tritt als Nitrosyl-Radikal in einkernigen Komplexen in linerarer oder gewinkelter Anordnung auf.[1]
Quellen
- ↑ Erwin Riedel; Moderne Anorganische Chemie, 3. Auflage, S. 663ff
Kategorien:- Stoffgruppe
- Stickstoffverbindung
Wikimedia Foundation.